
【题目】I.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7.2H2O),其主要工艺流程如下图:
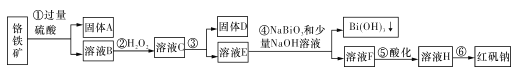
查阅资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的 pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)固体A的主要成分为____(填化学式)。
(2)步骤③加的试剂为氢氧化钠溶液,此时溶液pH要调到5.0的目的是____。
(3)写出④反应的离子反应方程式:____。
(4)取一定质量的固体D溶解于200 mL的硫酸中,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则加入NaOH溶液体积为200~240 mL时发生反应的化学方程式为____,固体D中含铁化合物的物质的量为____

Ⅱ.经检测该化工厂的工业废水中含5.00×10-3mol/L的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Fe的化合价依次为+3、+2),又设计了如下工艺流程:
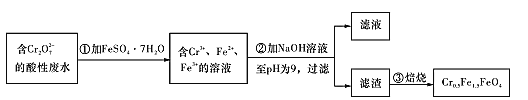
(5)第①步反应的离子方程式为____。
(6)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加FeSO4.7H2O的质量为 ___g(已知FeSO4.7H2O的摩尔质量为278 g/mol)。
【答案】SiO2 使Fe3+、Al3+均完全转化为Fe(OH)3、Al(OH)3沉淀除去,而Cr3+不沉淀 3NaBiO3+2Cr3++7OH- +H2O==2CrO42-+3Na++3Bi(OH)3 NaOH+Al(OH)3==NaAlO2+2H2O 0.1mol Cr2O72-+14H++6Fe2+==2Cr3++6Fe3++7H2O 13.9
【解析】
铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)中加入过量硫酸,FeO、Cr2O3、Al2O3溶解生成Cr2(SO4)3、FeSO4、Al2(SO4)3,从而得到溶液B,沉淀A为SiO2;溶液B中加入H2O2,Fe2+被氧化为Fe3+,得到溶液C;调节pH使Fe3+、Al3+全部转化为沉淀,得到固体D,所得溶液E中主要含有Cr3+;加入NaBiO3和少量NaOH溶液,此时生成的Bi3+转化为Bi(OH)3沉淀,Cr3+被氧化为CrO42-,得到溶液F;将溶液F酸化,CrO42-转化为Cr2O72-,得到溶液H;蒸发结晶得到红矾钠(主要成分Na2Cr2O7.2H2O)。
(1)由以上分析知,固体A的主要成分为SiO2。答案为:SiO2;
(2)步骤③中,需将Al3+、Fe3+除去,于是加入了氢氧化钠溶液,此时溶液pH要调到5.0的目的是使Fe3+、Al3+均完全转化为Fe(OH)3、Al(OH)3沉淀除去,而Cr3+不沉淀。答案为:使Fe3+、Al3+均完全转化为Fe(OH)3、Al(OH)3沉淀除去,而Cr3+不沉淀;
(3)步骤④中,加入NaBiO3和少量NaOH溶液,此时生成的Bi3+转化为Bi(OH)3沉淀,Cr3+被氧化为CrO42-,反应的离子反应方程式:3NaBiO3+2Cr3++7OH- +H2O==2CrO42-+3Na++3Bi(OH)3。答案为:3NaBiO3+2Cr3++7OH- +H2O==2CrO42-+3Na++3Bi(OH)3;
(4)从图中可以看出,NaOH溶液的体积,从200mL增加到240mL,主要是将Al(OH)3转化为AlO2-,发生反应的化学方程式为NaOH+Al(OH)3==NaAlO2+2H2O;则将Al3+转化为Al(OH)3,需要消耗NaOH溶液40mL×3=120mL,则Fe3+转化为Fe(OH)3需消耗NaOH溶液200mL-20mL-120mL=60mL,n[Fe(OH)3]=![]() ×5 mol/L×0.06L=0.1mol。答案为:NaOH+Al(OH)3==NaAlO2+2H2O;0.1mol;
×5 mol/L×0.06L=0.1mol。答案为:NaOH+Al(OH)3==NaAlO2+2H2O;0.1mol;
Ⅱ.(5)第①步操作,Fe2+将Cr2O72-还原为Cr3+,Fe2+转化为Fe3+,发生反应的离子方程式为Cr2O72-+14H++6Fe2+==2Cr3++6Fe3++7H2O。答案为:Cr2O72-+14H++6Fe2+==2Cr3++6Fe3++7H2O;
(6)欲使1 L该废水中的n(Cr2O72-)=5.00×10-3mol/L×1L=5.00×10-3mol,依据质量守恒,完全转化为Cr0.5Fe1.5FeO4的物质的量为0.02mol,理论上需要加FeSO4.7H2O的物质的量为0.02mol×2.5=0.05mol,质量为0.05mol×278 g/mol =13.9g。答案为:13.9。


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】有关离子交换法软化硬水的下列叙述中,正确的是( )
A.磺化煤能使具有永久硬度的水软化,是因为它能除去水中的Ca2+、Mg2+、S![]() 和Cl-等
和Cl-等
B.经磺化煤软化处理后,软水中Na+浓度增大
C.磺化煤使硬水软化以及磺化煤的再生,这两种操作可以在同一离子交换柱中同时进行
D.失去软化硬水能力的磺化煤,不可能恢复它的软化能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)可用作火箭推进剂等。制备NH4ClO4的工艺流程如下:
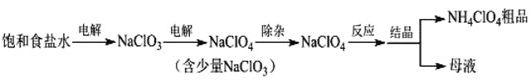
(1)电解NaClO3溶液时,ClO3-在____极发生反应,其电极反应式为____。
(2)“除杂”有两种方案。
①方案1:加入盐酸和H2O2溶液,NaClO3转化为ClO2,化学方程式为______。
方案2:加入氨水和FeCl24H2O,NaClO3转化为Cl-,离子方程式为____,如果FeCl24H2O过量会出现黑色磁性沉淀,该沉淀可能是______。(填化学式)
②比较氧化性:ClO3-_____ClO4-(填“>”或“<”)。
③两种方案相比,方案1的优点是____。(答一条即可)
(3)“反应”时用NaClO4和NH4Cl在90℃制备NH4ClO4。如果用浓盐酸和液氨代替NH4Cl,则无需加热,原因是____。
(4)该流程中可循环利用的物质是_________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。
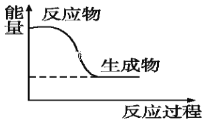
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POCl3是重要的化工原料,某兴趣小组准备用三氯化磷、氯气、二氧化硫制备POC13,产物中还有一种遇水强烈水解的物质SOCl2,用下列装置完成实验。
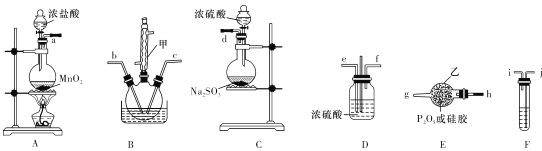
已知:PCl3熔点-93.6℃、沸点76.1℃,遇水强烈水解,易与氧气反应;POCl3遇水强烈水解,能溶于PCl3。
(1)仪器甲的名称是 ___。
(2)已知装置B制备POC13,以上仪器接口连接的顺序为a- ___b-c-g-h-d,装置F中所装试剂为 ___,装置B中发生反应的化学方程式为 ______.
(3)B中反应温度控制在60-- 65℃,其原因是 _____________
(4)用佛尔哈德法测定POC13含量:准确称取20. 20 g POCl3产品,置于盛有60. 00 ml蒸馏水的水解瓶中摇动至完全水解;将水解液配成100. 00 mL溶液,取10. 00 mL溶液于锥形瓶中;加入10. 00 mL3.200 mol/L AgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;加入指示剂,用0. 200 0 mol/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mLKSCN溶液。[已知:Ksp(AgCl) =3.2×10-10,Ksp(AgSCN) =2×10-12]
①滴定选用的指示剂是________:填字母代号),滴定终点的现象为____。
A.FeCl2 B.NH4Fe(SO4)2 C.淀粉 D.甲基橙
②用硝基苯覆盖沉淀的目的是____。
③产品中POC13的百分含量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一种金属单质A,焰色反应颜色呈黄色,能发生如图所示变化:

上图中淡黄色固体B是_____________(填化学式)
(2)二氧化氮(NO2)是一种红棕色的有毒气体,二氧化氮与水反应生成硝酸和___。
(3)写出(1)中C溶液与硝酸反应的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H,上述反应分两步完成,其反应历程如图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如图所示:
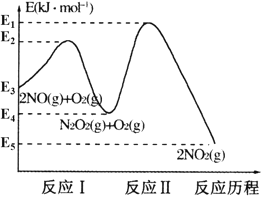
回答下列问题:
(1)写出反应I的热化学方程式___。
(2)反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是___(反应未使用催化剂)。
2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是___(反应未使用催化剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物心舒宁(又名冠心宁)是一种有机酸盐,用于治疗心脉瘀阻所致的冠心病、心绞痛等,可用以下路线合成。
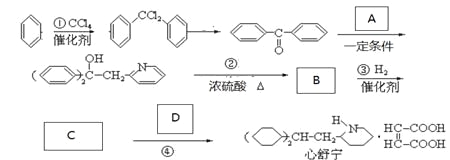
完成下列填空:
47、写出反应类型:反应①______________、反应②_______________。
48、写出结构简式:A__________________、C____________________。
49、由1mol B转化为C,消耗H2的物质的量为_______________。如果将③、④两步颠倒,则最后得到的是(写结构简式)__________________________。
50、D有同类别的同分异构体E,写出E与乙二醇发生缩聚反应所得产物的结构简式______________。
51、写出与A的属于芳香族化合物的同分异构体与盐酸反应的化学方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com