
����Ŀ���������(NH4ClO4)����������ƽ����ȡ��Ʊ�NH4ClO4�Ĺ����������£�
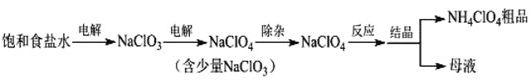
(1)���NaClO3��Һʱ��ClO3-��____��������Ӧ����缫��ӦʽΪ____��
(2)�������������ַ�����
�ٷ���1�����������H2O2��Һ��NaClO3ת��ΪClO2����ѧ����ʽΪ______��
����2�����백ˮ��FeCl24H2O��NaClO3ת��ΪCl-�����ӷ���ʽΪ____�����FeCl24H2O��������ֺ�ɫ���Գ������ó���������______��(�ѧʽ)
�ڱȽ������ԣ�ClO3-_____ClO4-(����>������<��)��
�����ַ�����ȣ�����1���ŵ���____��(��һ������)
(3)����Ӧ��ʱ��NaClO4��NH4Cl��90���Ʊ�NH4ClO4�������Ũ�����Һ������NH4Cl����������ȣ�ԭ����____��
(4)�������п�ѭ�����õ�������_________��(�ѧʽ)
���𰸡��� ClO3-+H2O-2e- =ClO4-+2H+ 2NaClO3+2HCl+H2O2=2ClO2��+2NaCl+2H2O+O2�� 6Fe2++ClO3-+3H2O+12NH3H2O=6Fe(OH)3��+Cl-+12NH4+ Fe3O4 ![]() ���������(�������H2O2�׳�ȥ�Ⱥ�����) Ũ�����Һ���ķ�ӦΪ���ȷ�Ӧ NaCl
���������(�������H2O2�׳�ȥ�Ⱥ�����) Ũ�����Һ���ķ�ӦΪ���ȷ�Ӧ NaCl
��������
(1)��������ӻ��ϼ�Ϊ+5�����ߵ�����������ӵ�+7�ۣ�����������Ӧ��Ϊ������Ӧ��
(2)��˫��ˮ�������ƻ�ԭΪ�������ȣ���ˮ���������ӡ���������ӷ�Ӧ���������ӡ���������������笠����ӣ����FeCl24H2O��������ֺ�ɫ���Գ���������������
�ڸ������Ϸ�������������������Դ��ڸ���������ӣ�
�۷���1���ŵ��Dz��������
(3)Ũ�����Һ��Ϊ���ȷ�Ӧ��
(4)���������жϡ�
(1)��������ӻ��ϼ�Ϊ+5�����ߵ�����������ӵ�+7�ۣ�����������Ӧ��������������Ӧ����ӦʽΪ��ClO3-+H2O-2e- =ClO4-+2H+��
(2)��˫��ˮ�������ƻ�ԭΪ�������ȣ�����ʽΪ��2NaClO3+2HCl+H2O2=2ClO2��+2NaCl +2H2O+O2������ˮ���������ӡ���������ӷ�Ӧ���������ӡ���������������笠����ӣ����ӷ���ʽΪ��6Fe2++ClO3-+3H2O+12NH3H2O=6Fe(OH)3��+Cl-+12NH4+�����FeCl24H2O��������ֺ�ɫ���Գ������ó���������������������
�ڸ������Ϸ�������������������Դ��ڸ���������ӣ�
�����ַ�����ȣ�����1���ŵ��Dz��������(�������H2O2�׳�ȥ�Ⱥ�����)��
(3)����Ũ�����Һ���ķ�ӦΪ���ȷ�Ӧ���ʷ�Ӧ������ȣ�
(4)�������̿�֪���������п�ѭ�����õ��������Ȼ��ơ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩΪ��Ҫԭ�ϣ����Ժϳ�A��C��E�����ʣ���ϳ�·����ͼ��ʾ�����ַ�Ӧ������ԭ�ϡ���������ȥ����
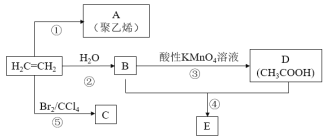
��ش��������⣺
(1)A�Ľṹ��ʽΪ______________��
(2)��Ӧ�ܵĻ�ѧ��Ӧ����Ϊ___________________��
(3)��Ӧ�ݵĻ�ѧ����ʽΪ_________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�÷�Ӧ4NH3+5O2=4NO+6H2O�У�����Ӧ���ʷֱ���v��NH3����v��O2����v��NO����v��H2O����ʾ������ȷ�Ĺ�ϵ��
A.![]() v��NH3��=v��O2��B.
v��NH3��=v��O2��B.![]() v��O2��=v��H2O��
v��O2��=v��H2O��
C.![]() v��NH3��=v��H2O��D.
v��NH3��=v��H2O��D.![]() v��O2��=v��NO��
v��O2��=v��NO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1�����������������ϣ�Ҳ�ɺϳ��������ϡ�ʵ�����Ʊ�1���������Ĺ������£�
 +CH3CH2OH
+CH3CH2OH![]()
 +H2O
+H2O
��֪��1���ӵ������뱽�����ƣ������ŵı�����ζ��������ʵ�����������
���� | ��Է������� | ״̬ | �۵�(��) | �е�(��) | �ܽ�� | |
ˮ | �Ҵ� | |||||
1���� | 144 | ��ɫ���ɫ���νᾧ���ĩ | 96�� | 278�� | ����ˮ | �������Ҵ� |
1�������� | 172 | ��ɫҺ�� | 5.5�� | 267�� | ������ˮ | �������Ҵ� |
�Ҵ� | 46 | ��ɫҺ�� | 114.1�� | 78.5�� | ����Ȼ��� | |
(1)��һ����1����������ˮ�Ҵ��У�����������Ũ�����ϡ������Һ������ͼ��ʾ�������м��ȳ�ַ�Ӧ��ʵ����ʹ�ù����Ҵ���ԭ����__________��
(2)װ���г������ܵ������ǣ�______��
(3)�÷�Ӧ������ʵ�����Ʊ�����������װ�ã���������____________��
(4)��Ӧ��������Ҫ�ᴿ���������ĺ�����������Ӧ���������ƣ�������ˮ����ϴ��_______ �� ˮϴ��_______ ������CaCl2���ﲢ______��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֵ�ⷨ�ϳɰ���װ����ͼ��ʾ���÷����ø����ӵ����Ե� SCY �մɣ�������������������ϵĽ��� Pd �ྦྷ��Ĥ���缫��ʵ���� 570������ѹ�¸�ת���ʺϳɰ�������������ȷ����
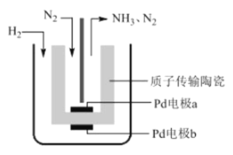
A.�����ĵ缫��ӦʽΪ N2 +8H+ +6e����2NH4+
B.��װ�ù���ʱ��H+ �� a ������ b ����Ǩ��
C.ÿ���� 1mol NH3 ���� 3g H2 ������
D.��װ��ʵ�����ڳ��³�ѹ�¸�ת���ʺϳɰ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ���Ӻ�ˮ��ȡ����ռ�����������������֮һ���ң������������ǹ�ҵ��ģ��ˮ����ij��÷���������һ�ֹ�������Ϊ���ٺ�ˮŨ�����ữ����ͨ��Cl2��ʹBr�� ת��ΪBr2����ͨ�������ˮ��������Br2�����������������ռ�SO2��Ӧת��ΪHBr����ͨ��Cl2���پ���һϵ�д����õ���ƷBr2����ش��������⣺
��1������ڡ��۲�����Ŀ����_____��������������������ȡ��������
��2���ڲ�����У�����HBr�Ļ�ѧ����ʽ��___________��
��3���ڲ�����У���ͨ��22.4LCl2����״�����������Ͽɵ�Br2__________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��ij�������Ը�����(��Ҫ�ɷ�ΪFeO��Cr2O3������Al2O3��SiO2�����ʣ�Ϊ��Ҫԭ����������ԭ�Ϻ췯��(��Ҫ�ɷ�Na2Cr2O7��2H2O)������Ҫ������������ͼ��
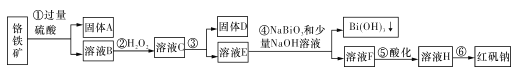
�������ϵ�֪��
i�������£�NaBiO3������ˮ����ǿ�����ԣ��ڼ��������£��ܽ�Cr3+ת��ΪCrO42-��
ii��
�������� | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
��ʼ������ pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
������ȫ��pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
�ش��������⣺
(1)����A����Ҫ�ɷ�Ϊ____���ѧʽ����
(2)����ۼӵ��Լ�Ϊ����������Һ����ʱ��ҺpHҪ����5.0��Ŀ����____��
(3)д���ܷ�Ӧ�����ӷ�Ӧ����ʽ��____��
(4)ȡһ�������Ĺ���D�ܽ���200 mL�������У���������Һ�м���5 mol/L��NaOH��Һ�����ɳ��������ʵ���n�����NaOH��Һ�����V��ϵ��ͼ��ʾ�������NaOH��Һ���Ϊ200~240 mLʱ������Ӧ�Ļ�ѧ����ʽΪ____������D�к�������������ʵ���Ϊ____

�����û������Ĺ�ҵ��ˮ�к�5.00��10-3mol/L��Cr2O72-���䶾�Խϴû������Ŀ�����ԱΪ�˱��Ϊ��������ˮ�����õ����Բ���Cr0.5Fe1.5FeO4 (Fe�Ļ��ϼ�����Ϊ+3��+2)������������¹������̣�
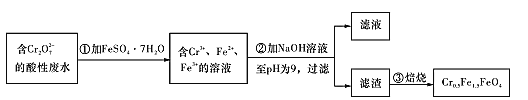
(5)�ڢٲ���Ӧ�����ӷ���ʽΪ____��
(6)��ʹ1 L�÷�ˮ�е�Cr2O72-��ȫת��ΪCr0.5Fe1.5FeO4����������Ҫ��FeSO4��7H2O������Ϊ ___g(��֪FeSO4.7H2O��Ħ������Ϊ278 g/mol)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪: 25�桢101 kPaʱ��
I.H2��g�� + ![]() O2��g�� = H2O��g�� ��H1 =- 241.8kJ/mol
O2��g�� = H2O��g�� ��H1 =- 241.8kJ/mol
II.H2��g�� + ![]() O2��g�� = H2O��l�� ��H2 =-2858kJ/mol
O2��g�� = H2O��l�� ��H2 =-2858kJ/mol
�Իش���������:
���ܱ�ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ____ ������I�� ����II����
��H2O��g�� = H2O��l�� ��H = ___ kJ/mol��
��2����֪: 25�桢101 kPaʱ��CO��g�� + H2O��g��![]() CO2��g�� + H2��g�� ��H = -41.0 kJ/mol����1molCO��Imol H2O��g������1L���ܱ������У���һ�������·�Ӧ�ﵽƽ�⡣�Իش���������:
CO2��g�� + H2��g�� ��H = -41.0 kJ/mol����1molCO��Imol H2O��g������1L���ܱ������У���һ�������·�Ӧ�ﵽƽ�⡣�Իش���������:
�ٷų�������___41.0kJ������>������<������=������
�ڸ÷�Ӧ��ƽ�ⳣ������ʽK =__
��������������ʱ�������¶ȣ�c��H2����__
A �� B С C ��
��3�������£�����0.1mol/L FeCl3��Һ:
�ٸ���Һ��___�������������� ����������������"��;
��Ϊ����Fe3+�����붨����ˮ����pH����c(Fe3+)= 4.0��10-5mol/Lʱ����Һ��pH=__�� ��֪Ksp[Fe(OH)3]= 4.0��10-38����
��4����ͼ�ǵ��CuSO4��Һ��װ��ʾ��ͼ��a��b�ǵ�Դ��������x��y����ʯī�缫��ͨ��һ��ʱ���y���������ݲ������Իش���������:�ٵ�Դ��������__���� ��a������b���������й���Һ�仯��������ȷ����______��
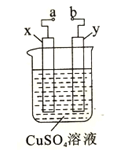
A��pH����
B��SO42-Ũ�ȼ�С
C��Cu2+Ũ������
��x���ĵ缫��ӦʽΪ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ�����A��Ԫ�صĵ��ʼ��仯�������;�㷺��
23���������壨BrF3�������ں�ȼ�������ͺ�������ˮ�����������·�Ӧ��3BrF3 +5H2O �� HBrO3+ Br2+ 9HF+ O2 ���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ________��ÿ����2.24 LO2����״����ת�Ƶ�����Ϊ__________��
24����ʳ����������������ؿ�Ԥ��ȱ�⡣Ϊ�˼���ʳ���еĵ���أ��ɼ������͵���-�⻯����Һ��������������________________________����Ӧ�����ӷ���ʽ��_______________________��
�ȳ���������ˮ��ɱ��������HClO��ɱ��������ClO��ǿ��25��ʱ����-��ˮ��ϵ�д�������ƽ���ϵ��
Cl2(g)![]() Cl2(aq) ---------------��
Cl2(aq) ---------------��
Cl2(aq)+ H2O![]() HClO + H++Cl��-----��
HClO + H++Cl��-----��
HClO![]() H++ ClO��---------------��
H++ ClO��---------------��
����Cl2(aq)��HClO��ClO���ֱ�����������ռ����(��)��pH�仯�Ĺ�ϵ��ͼ��ʾ��
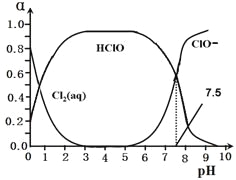
25��д��������ϵ�����ڵ���ƽ���ƽ�ⳣ������ʽ��Ki =_______����ͼ��֪�ó���ֵΪ_________��
26���ڸ���ϵ��c(HClO) + c(ClO��)_______c(H+)��c(OH��)��������������С������������������
27�����ȴ�������ˮʱ���ļ���ɱ��Ч���ȶ���______����������������������������������ԭ������________________________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com