
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。根据下图,完成下列填空:
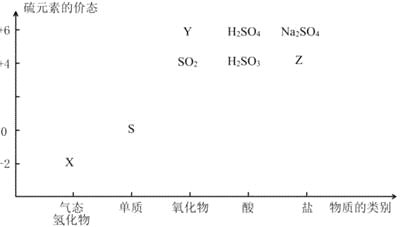
(1)上图中X的电子式为_________;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化__________;该变化体现出硫元素的非金属性比氧元素______(填“强”或“弱”)。用原子结构解释原因____________。
(2)Na2S2O3是一种用途广泛的钠盐。下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a.Na2S+ S b.Z+ S c.Na2SO3 + Y d.NaHS + NaHSO3
(3)SO2是主要大气污染物之一。工业上烟气脱硫的方法之一是用碱液吸收,其流程如图: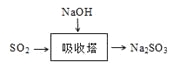 。
。
该法吸收快,效率高。若在操作中持续通入含SO2的烟气,则最终产物为________。室温下,0.1mol/L①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫氢化钠的四种溶液的pH由大到小的顺序是________(用编号表示)。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2SO3:Ki1=1.3×10-2 Ki2=6.2×10-8
(4)治理含CO、SO2的烟道气,也可以将其在催化剂作用下转化为单质S和无毒的气体:2CO(g) + SO2(g)![]() S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是______(填写字母序号)。
S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是______(填写字母序号)。
a.υ (CO) ∶υ(SO2) = 2∶1 b.平衡常数不变
c.气体密度不变 d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为![]() ,则SO2的转化率为________。
,则SO2的转化率为________。
【答案】![]() 2H2S + O2 =2S↓+2H2O 弱 氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱 bd NaHSO3 ③>①>④>② cd 60%
2H2S + O2 =2S↓+2H2O 弱 氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱 bd NaHSO3 ③>①>④>② cd 60%
【解析】
(1)根据图示X为S的气态氢化物,X是H2S,H2S的电子式为![]() ;H2S的水溶液长期在空气中放置容易被空气中的氧气氧化生成硫,反应的化学方程式为O2+2H2S=2S↓+2H2O,该变化体现出硫元素的非金属性比氧元素弱,原因是:氧和硫同主族,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱。
;H2S的水溶液长期在空气中放置容易被空气中的氧气氧化生成硫,反应的化学方程式为O2+2H2S=2S↓+2H2O,该变化体现出硫元素的非金属性比氧元素弱,原因是:氧和硫同主族,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱。
(2)Na2S2O3中S显+2价;a.Na2S、S中S元素的化合价依次为-2价、0价,均低于+2价,不可能;b.根据图示Z为Na2SO3,Na2SO3、S中S元素的化合价依次为+4价、0价,满足高价跟低价生成中间价态,可能;c.根据图示Y为SO3,Na2SO3、SO3中S元素的化合价依次为+4价、+6价,均高于+2价,不可能;d.NaHS 、NaHSO3中S元素的化合价依次为-2价、+4价,满足高价跟低价生成中间价态,可能;答案选bd。
(3)若在操作中持续通入含SO2的烟气,最终SO2与Na2SO3反应生成NaHSO3,即最终产物为NaHSO3;根据电离平衡常数可知,酸性:H2SO3>H2S>HSO3->HS-,结合越弱越水解,硫化钠的水解程度最大,pH最大,亚硫酸氢钠水解程度最小,pH最小,故四种溶液的pH由大到小的顺序是③>①>④>②。
(4)a.υ (CO) ∶υ(SO2) = 2∶1没有指明反应速率的方向,不能说明反应达到平衡;b.平衡常数只与温度有关,平衡常数不变不能说明反应达到平衡;c.气体密度与气体的质量有关,因为S是固体,该反应属于气体质量变化的反应,气体密度不变,表示气体质量不变,说明是平衡状态;d.CO2和SO2的体积比保持不变,表示正反应速率等于逆反应速率,说明是平衡状态;答案选cd。
设起始加入SO2物质的量为x,转化SO2物质的量为y
2CO(g) + SO2(g)![]() S(s) + 2CO2(g)
S(s) + 2CO2(g)
起始(mol) 4x x 0
转化(mol) 2y y 2y
平衡(mol) 4x-2y x-y 2y
平衡时CO的体积分数=![]() ,解得y=
,解得y=![]() ,SO2的转化率为
,SO2的转化率为![]() =60%。
=60%。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知PH3与NH3结构相似,回答下列问题:
①PH3的电子式________,结构式________。
②几何构型为________。
③中心原子采取________杂化。
④PH3分子中的化学键________(填“有”或“无”)极性,其分子为________(填“极性”或”非极性”)分子。
⑤PH3与NH3的热稳定性:________更强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为主要原料,可以合成A、C、E等物质,其合成路线如图所示(部分反应条件、原料、产物已略去)。
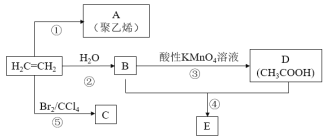
请回答下列问题:
(1)A的结构简式为______________。
(2)反应④的化学反应类型为___________________。
(3)反应⑤的化学方程式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液均为0.1mol·L-1,有关叙述正确的是( )
A.碳酸氢钠溶液中c(H2CO3)>c(CO32-)
B.碳酸钠溶液比碳酸氢钠溶液的pH小
C.碳酸钠溶液中c(OH-)=c(H+)+c(H2CO3)+c(CO32-)
D.碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质只有NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,0.1000mol/L Na2CO3溶液25mL用0.1000mol/L盐酸滴定,滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列说法正确的是
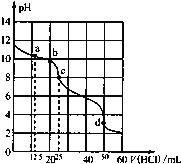
A.a点:c(CO32-)>c(HCO3﹣)>c(OH﹣)
B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)=c(H+)+c(HCO3﹣)+2c(H2CO3)
D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要用480mL0.1molL-1的硫酸铜溶液,以下配制方法正确的是( )
A. 称取![]() 胆矾(CuSO4·5H2O),配成500mL溶液
胆矾(CuSO4·5H2O),配成500mL溶液
B. 称取![]() 胆矾(CuSO4·5H2O),加入500mL水配成溶液
胆矾(CuSO4·5H2O),加入500mL水配成溶液
C. 称取![]() 无水硫酸铜粉末,加入480mL水配成溶液
无水硫酸铜粉末,加入480mL水配成溶液
D. 称取![]() 无水硫酸铜粉末,加入500mL水配成溶液
无水硫酸铜粉末,加入500mL水配成溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知该反应4NH3+5O2=4NO+6H2O中,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
A.![]() v(NH3)=v(O2)B.
v(NH3)=v(O2)B.![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C.![]() v(NH3)=v(H2O)D.
v(NH3)=v(H2O)D.![]() v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1乙氧基萘常用作香料,也可合成其他香料。实验室制备1乙氧基萘的过程如下:
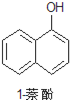 +CH3CH2OH
+CH3CH2OH![]()
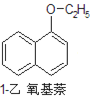 +H2O
+H2O
已知:1萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醇 | |||||
1萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | 114.1℃ | 78.5℃ | 任意比混溶 | |
(1)将一定量1萘酚溶于无水乙醇中,并加入少量浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是__________。
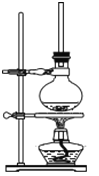
(2)装置中长玻璃管的作用是:______。
(3)该反应不能用实验室制备乙酸乙酯的装置,简述理由____________;
(4)反应结束,需要提纯产物,在下面的横线上填上相应操作的名称:倒入冷水,碱洗并_______ → 水洗并_______ →加入CaCl2干燥并______→___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知: 25℃、101 kPa时,
I.H2(g) + ![]() O2(g) = H2O(g) △H1 =- 241.8kJ/mol
O2(g) = H2O(g) △H1 =- 241.8kJ/mol
II.H2(g) + ![]() O2(g) = H2O(l) △H2 =-2858kJ/mol
O2(g) = H2O(l) △H2 =-2858kJ/mol
试回答下列问题:
①能表示氢气燃烧热的热化学方程式为____ (填“I” 或“II”)
②H2O(g) = H2O(l) △H = ___ kJ/mol。
(2)已知: 25℃、101 kPa时,CO(g) + H2O(g)![]() CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
①放出的热量___41.0kJ(填“>”、“<”或“=”);
②该反应的平衡常数表达式K =__
③其他条件不变时,升高温度,c(H2)将__
A 大 B 小 C 变
(3)常温下,现有0.1mol/L FeCl3溶液:
①该溶液呈___(填“酸性”、 “碱性”或“中性");
②为沉淀Fe3+,加入定量氨水调节pH,当c(Fe3+)= 4.0×10-5mol/L时,溶液的pH=__( 已知Ksp[Fe(OH)3]= 4.0×10-38)。
(4)如图是电解CuSO4溶液的装置示意图。a、b是电源的两极,x、y都是石墨电极。通电一段时间后,y极上有气泡产生。试回答下列问题:①电源的正极是__(填 “a”或“b”);②有关溶液变化的描述正确的是______;
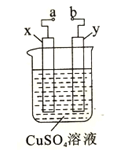
A.pH降低
B.SO42-浓度减小
C.Cu2+浓度增大
③x极的电极反应式为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com