
【题目】下表是元素周期表的一部分:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)从原子结构角度分析,D、E、G、I四种元素处于同一行,是由于它们的_______相同。E和F元素在周期表处于同一列是由于它们的______相同。
(2)E元素的最低化合价为___________,原子半径:r(E)_________ r(D)![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,离子半径:r(G)_________ r(C)(填“
,离子半径:r(G)_________ r(C)(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
(3)在表中所列元素中最高价氧化物对应水化物中酸性最强的是________(写化学式)。
(4)科学家通过对某些元素的化合物进行研究,寻找高效农药。这些元素往往位于元素周期表的 _____________(选填序号)。
a.左下角区域 b.右上角区域 c.左上角区域 d.右下角区域
【答案】电子层数 最外层电子数 ![]()
![]()
![]()
![]() b
b
【解析】
根据元素周期表得出元素符号,再根据非金属性越强,其最高价氧化物对应水化物酸性越强,以及通过元素周期表分析元素的应用。
(1)D、E、G、I四种元素处于同一行,是由于它们的电子层数相同。E和F元素在周期表处于同一列是由于它们的最外层电子数相同,故答案为:电子层数;最外层电子数。
(2)E元素最外层电子数是5个,最低化合价为5-8=-3,原子半径从左到右,逐渐减小,因此:r(E) < r(D),根据核多径小(同电子层结构),离子半径:r(G) > r(C),故答案为:-3;<;>。
(3)从左到右,非金属性增强,最高价氧化物对应水化物的酸性越强,因此表中所列元素中最高价氧化物对应水化物中酸性最强的是HClO4,故答案为:HClO4。
(4)科学家通过对某些元素的化合物进行研究,寻找高效农药,主要为非金属元素,因此这些元素往往位于元素周期表的右上角区域,故答案为:b。


科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,回答下列问题:

(1)该注射液中葡萄糖的质量分数为___________;
(2)该注射液中葡萄糖的物质的量浓度为__________。(保留两位小数)
(3)检测人的血液中葡萄糖(简称血糖,相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ △H>0。
CH3COO-+H+ △H>0。
(1)下列方法中,可以使0.10 mol/L CH3COOH的电离程度增大的是_______(用序号填写)。
a.加入少量0.10 mol/L的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol/L d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol/L的NaOH溶液
(2)将等质量的锌粒投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积关系为V(盐酸)_____V(醋酸)(填写“>”、“<”或“=").
(3)常温下,向体积为VamL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液VbmL至溶液恰好呈中性,则Va与Vb的关系为: Va______Vb(填写“>”、“<”或“=”)。
(4)已知: 某温度时,水的离子积常数为Kw=1.0×10-12,在此温度下,将pH=1的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=_______mol/L。
Ⅱ.结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
请回答下列问题:
(1) 同浓度的CH3COO-、HCO3/span>-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是_________。
(2) 0.1mo1/L的H2C2O4溶液与0.1mo1/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为________________。
(3)pH相同的NaC1O和CH3COOK溶液中,[c(Na+)-c(C1O-)]______[c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(4) 向0.1mo1/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以![]() 、
、![]() 、
、![]() 、
、![]() 的形式存在。
的形式存在。
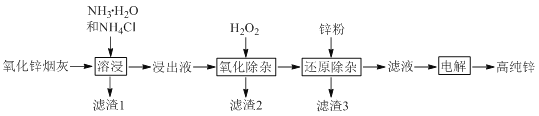
回答下列问题:
![]() 中Zn的化合价为_______,“溶浸”中ZnO发生反应的离子方程式为_______。
中Zn的化合价为_______,“溶浸”中ZnO发生反应的离子方程式为_______。
![]() 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析![]() 时锌浸出率最高的原因为_______。
时锌浸出率最高的原因为_______。

![]() “氧化除杂”中,
“氧化除杂”中,![]() 转化为
转化为![]() 胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______。
胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______。
![]() “滤渣3”的主要成分为_______。
“滤渣3”的主要成分为_______。
![]() “电解”时
“电解”时![]() 在阴极放电的电极反应式为______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的
在阴极放电的电极反应式为______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的![]() 溶液中,无明显现象,该气体是_______
溶液中,无明显现象,该气体是_______![]() 写化学式
写化学式![]() 。电解后的电解液经补充_______
。电解后的电解液经补充_______![]() 写一种物质的化学式
写一种物质的化学式![]() 后可返回“溶浸”工序继续使用。
后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物。
试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______。
(2)D元素位于周期表中______周期___________族。
(3)写出AB2与C2B2反应的化学方程式________________________________________________。
(4)画出B的原子结构简图 ___________________。
(5)用电子式表示化合物 C2D 的形成过程:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH = –511kJmol-1

可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a管的作用是________。
(2)A中反应的离子方程式是________。
(3)D的作用是________。
(4)E中冷却水的作用是________。
(5)尾气处理时,可选用的装置是________(填序号)。

(6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有________(填序号)。
A.蒸馏烧瓶 B.温度计 C.接收器 D.冷凝管 E.吸滤瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中时刻存在着氮气的转化。实现氮气按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图。下列叙述正确的是( )
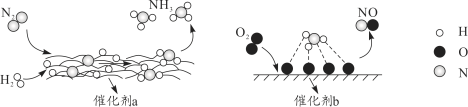
A.N2→NH3,NH3→NO均属于氮的固定
B.在催化剂a作用下,N2发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题

①写出仪器的名称:A.____,B.____。
②实验时A中除加入自来水外,还需加入少量____,其作用是____。
③改正图中两处明显的错误。
ⅰ__________;
ⅱ__________。
④收集完蒸馏水后,是先撤酒精灯还是先停冷凝水?_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com