
【题目】已知铅蓄电池放电时的反应为![]() 。某兴趣小组用铅蓄电池电解饱和食盐水的装置如下图所示,下列说法正确的是
。某兴趣小组用铅蓄电池电解饱和食盐水的装置如下图所示,下列说法正确的是
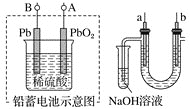
A.铅蓄电池A极应与U形管中a极连接
B.a、b两极均可用金属铁作电极
C.a电极用铁作电极,b电极用石墨作电极
D.实验结束后可将U形管、试管中的溶液倒入下水道
【答案】A
【解析】
根据铅蓄电池总反应,Pb为负极,PbO2为正极,电解饱和食盐水,发生2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,因氯气有毒,不能排放到空气中,应用NaOH吸收,即a电极产生Cl2,,a为阳极,b为阳极,据此分析;
2NaOH+H2↑+Cl2↑,因氯气有毒,不能排放到空气中,应用NaOH吸收,即a电极产生Cl2,,a为阳极,b为阳极,据此分析;
A. 铅蓄电池放电时,负极是Pb、正极是PbO2,电解饱和食盐水时,a极作阳极生成氯气,与原电池的正极相连,即与A电极相连,故A正确;
B. 电解饱和食盐水,发生2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,a极作阳极,应该用惰性电极,a电极不能用铁作电极,故B错误;
2NaOH+H2↑+Cl2↑,a极作阳极,应该用惰性电极,a电极不能用铁作电极,故B错误;
C. a极作阳极,应该用惰性电极,所以a电极不能用铁作电极,故C错误;
D. 电解后试管中生成次氯酸钠溶液,具有强氧化性,不能直接倒入下水道,故D错误;
答案:A。


科目:高中化学 来源: 题型:
【题目】某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下 :(废料中的其他金属含量较低,对实验影响可忽略)

已知:① AgCl可溶于氨水,生成[Ag(NH3)2]+;
② Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取____________措施(写出其中一种即可)。
(2)操作IV经过_______________、_________________、过滤、洗涤和干燥,可以得到硫酸铜晶体。
(3)洗涤滤渣II,与粗银合并,目的是________________________________。
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为_________________________________(其中AgCl和NaCl的物质的量之比为2:1)。氧化的同时发生沉淀转化,离子方程式为______________________________,其平衡常数K=_____________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol/L 的盐酸滴定相同浓度的25 mL溴化肼(N2H5Br)溶液,已知肼(N2H4)是二元弱碱,N2H4+H2O ![]() N2H5+ + OH- Kb1 = 1.0 × 10-6,N2H5+ + H2O
N2H5+ + OH- Kb1 = 1.0 × 10-6,N2H5+ + H2O ![]() N2H62+ + OH- Kb2 = 1.3 × 10-15,滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是( )
N2H62+ + OH- Kb2 = 1.3 × 10-15,滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是( )

A.N2H4与硫酸反应形成的酸式盐的化学式为N2H6(HSO4)2
B.b点表示盐酸与溴化肼恰好完全反应:c(Cl-)=c(Br-)>c(N2H62+)
C.a点对应的溶液中:c(Br-)+c(OH-) ═ c(N2H5+)+2c(N2H62+)+c(H+)
D.c点的混合溶液中:c(Cl-)>c(Br-)>c(H+)>c(N2H62+)>c(N2H5+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是( )

A.曲线I表示MnS的沉淀溶解平衡曲线
B.升高温度,曲线Ⅱ上的c点可沿虚线平移至d点
C.常温下,反应MnS(s)+Fe2+(aq)![]() FeS(s)+Mn2+(aq)的平衡常数K≈4×104
FeS(s)+Mn2+(aq)的平衡常数K≈4×104
D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿工线向a点方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银由于其优良的性能和特性被广泛应用于照相、电子、电气等工业。废定影液中银主要以Na3Ag(S2O3)2形式存在,实验室用废定影液制备Ag的具体流程如图所示:
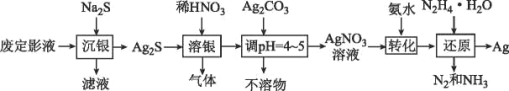
注:“还原”时由于Ag+直接与N2H4H2O反应过于激烈,所以采用加入氨水,使Ag+与氨形成[Ag(NH3)2]+,降低Ag+的浓度,从而相应降低Ag+的氧化能力,使反应能够平稳进行。
回答下列问题:
(1)“溶银”时产生的气体是___(填化学式)。
(2)N2H4H2O(水合肼)为无色透明的油状发烟液体,具有强还原性,实验室制备原理为NaClO+2NH3=N2H4H2O+NaCl,可能用到的实验装置如图所示:
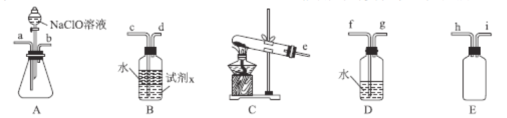
①本实验中用不到的装置是___。(填字母),试剂x是___(填化学式,任写一种)。
②加入NaClO溶液时要慢慢滴加,目的是___。
③按气流从左到右的方向,整套装置的连接顺序为___(填仪器接口小写字母)。
(3)AgNO3见光或受热易分解。将上述流程中AgNO3溶液蒸发浓缩可获得AgNO3固体,实验装置如图所示:
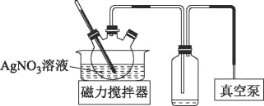
①使用真空泵的目的是___。
②测定AgNO3固体的纯度(杂质不参与反应)称取2.00g制备的AgNO3固体,加水溶解,定容到100mL;准确量取25.00mL溶液,酸化后滴入几滴NH4Fe(SO4)2溶液作指示剂,再用0.1000molL-1NH4SCN标准溶液滴定,消耗NH4SCN标准溶液的平均体积为29.00mL,则固体中AgNO3的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物中间体的合成路线如下![]() 下列说法正确的是()
下列说法正确的是()

A.对苯二酚在空气中能稳定存在
B.1mol该中间体最多可与11![]() 反应
反应
C.2,![]() 二羟基苯乙酮能发生加成、取代、缩聚反应
二羟基苯乙酮能发生加成、取代、缩聚反应
D.该中间体分子中含有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
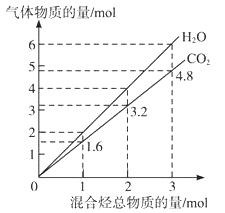
①一定有乙烯 ②一定有甲烷 ③一定有丙烷
④一定没有乙烷 ⑤可能有甲烷 ⑥可能有乙炔
A. ②⑤⑥ B. ②⑥ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线 a 表示放热反应X(g)+Y(g) ![]() Z(g) + M(g) + N(s)进行过程中 X 的转化率随时间变化的关系。若要改变起始条件,使反应过程按 b 曲线进行,可采取的措施是( )
Z(g) + M(g) + N(s)进行过程中 X 的转化率随时间变化的关系。若要改变起始条件,使反应过程按 b 曲线进行,可采取的措施是( )
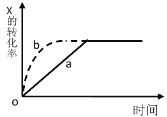
A.升高温度B.加大 X 的投入量
C.加催化剂D.增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,常温下通电5 min后,发现铜电极的质量增加,试回答:
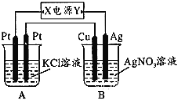
①电源电极X的名称为________(填“正极”或“负极”)。
②电解池B中阳极的电极反应式是________。
③若KCl溶液的体积是200 mL,则当铜电极的质量增加2.16g时A中溶液的pH=_____(忽略电解前后溶液体积的变化),若要使电解后的溶液恢复到与电解前完全相同的状态,则应加入____________(填物质的种类及数量)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com