
����Ŀ����������ۺ����ü������ڽ�Լ��Դ���������ڱ���������ʵ�������÷����ɵ�ص�ͭñ(Zn��Cu�ܺ���ԼΪ99%)����ͭ���Ʊ�ZnO�IJ���ʵ��������£�
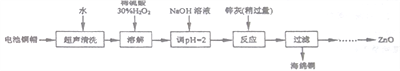
(1)��ͭñ�ܽ�ʱ����H2O2��Ŀ����___________________(�û�ѧ����ʽ��ʾ)��
��ͭñ�ܽ���轫��Һ�й���H2O2��ȥ����ȥH2O2�ļ�㷽����_________________��
(2)Ϊȷ������п��(��Ҫ�ɷ�ΪZn��ZnO������Ϊ������������)������ʵ������ⶨ��ȥH2O2����Һ��Cu2+�ĺ�����ʵ�����Ϊ��ȷȡһ������ĺ���Cu2+����Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�����pH=3��4���������KI����Na2S2O3����Һ�ζ����յ㡣���������е����ӷ���ʽ���£�2Cu2++4I-=2CuI(��ɫ)��+I2 I2+2S2O32-=2I-+S4O62-
�ٵζ�ѡ�õ�ָʾ��Ϊ_____________���ζ��յ�۲쵽������Ϊ_________________��
�����ζ�ǰ��Һ��H2O2û�г��������ⶨ��Cu2+�ĺ�������__________(�ƫ�ߡ��� ƫ�͡��� ���䡱)��
(3)��֪pH>11ʱZn(OH)2������NaOH��Һ����[Zn(OH)4]2-���±��г��˼����������������������pH(��ʼ������pH����������Ũ��Ϊ1.0mol��L-1����)
��ʼ������pH | ��ȫ������pH | |
Fe3+ | 1.1 | 3.2 |
Fe 2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
ʵ���п�ѡ�õ��Լ���30%H2O2��1.0mol��L-1HNO3��1.0mol��L-1NaOH��
�ɳ�ȥͭ����Һ�Ʊ�ZnO��ʵ�鲽������Ϊ��
������Һ�м���___________ʹ���ַ�Ӧ���ڵμ�1.0mol��L-1���������ƣ�����3.2��pH<5.9��ʹ___________������ȫ���۹��ˣ�������Һ�еμ�1.0 mol��L-1���������ƣ�����pHΪ________��pH��_______��ʹZn2+������ȫ���ݹ��ˡ�ϴ�ӡ������900�����ա�
���𰸡� Cu+H2O2+H2SO4=CuSO4+2H2O ����(����) ������Һ ��ɫ��ȥ��������ڲ��ָ� ƫ�� 30%��H2O2 Fe3+ 8.9 11
�����������÷Ͼɵ�ص�ͭñ(Zn��Cu�ܺ���ԼΪ99%)���� Cu���Ʊ�ZnO,���ͭñ����ˮ���˺��ȥ����ˮ������,�ڹ����м�����������ܽ�,ͭ��������ͭ��Һ,������н���Һ�й�����H2O2��ȥ,��������������Һ������ҺpH=2����������������п��(��Ҫ�ɷ�ΪZn��ZnO,����Ϊ������������),��Ӧ���˵õ�����ͭ,����п���ӵõ�������п,�ּ���ó�������п��(1)������������Cu��������ⷢ��������ԭ��Ӧ��������ͭ��ˮ���ڹ���������ȵ�153������ҵķֽ��� (2)�ٸ��ݵ�����ⵥ�����ñ���������ڸ���H2O2+2I-+2H+=I2+2H2O�����(3)�μ�H2O2��Һ,ʹFe2��ת����ȫΪFe3��,�μ�NaOH��Һ,�γ�������������,���Ӻ��γ�������п����,���ˡ�ϴ�ӡ�����900�������Ƶ�����п��
���: (1)����Ϊ˫��ˮ��������Һ���Ȱ�ͭ����������ͭ,��Ȼ����һ�����ķ�Ӧ,�γ�һ��ƽ��,�����γɵ�����ͭ���Ͼͻᱻϡ�����ܽ�,ƽ�ⱻ����,��Ӧ�����������,�ʶ����ܽ�,��Ӧ�Ļ�ѧ����ʽΪ: Cu+H2O2+H2SO4=CuSO4+2H2O����ˣ�������ȷ����: Cu+H2O2+H2SO4=CuSO4+2H2O��
�ڹ����������ʱȽ��ȶ�,�����ȵ�153������ҵķֽ�Ϊˮ������,����Һ�й�����H2O2��ȥ�ɼ�����������ˣ�������ȷ����:����������
(2)�ٵ�����ҺΪָʾ��,�����һ��Na2S2O3��Һ����ʱ,��Һ��ɫ��ȥ,�������ɫ����,˵���ζ������յ�����ˣ�������ȷ������������Һ����ɫ��ȥ��������ڲ��ָ���
��������H2O2,����KI��,�������·�Ӧ: H2O2+2I-+2H+=I2+2H2O����2Cu2++4I-=2CuI(��ɫ)��+I2�����ɵĵ�,ʹ�ⶨ���ƫ������ˣ�������ȷ����:ƫ��.
��ȥͭ����Һ�к���Fe3����Fe2����Zn2���ȣ����Ʊ�ZnOӦ��ȥFe3����Fe2�����ɱ�����Ϣ��֪��Fe2����Zn2����ʼ�����ͳ�����ȫ��pH������С����Fe3����Zn2����ʼ�����ͳ�����ȫ��pH�����ϴʿɼ���30% H2O2��Fe2��������Fe3�����ٵμ�NaOH��Һ��������Һ��pH(3.2��pH<5.9)��ʹFe3��������ȫ����ʱZn2����������������ַ�Ӧ����ˣ�����Һ�еμ�NaOH��Һ��������Һ��pH(8.9��pH��11)��ʹZn2������Zn(OH)2����������Zn(OH)2��������ϴ�ӡ�������գ����ɵõ�ZnO��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Cl2ͨ������NaOH��Һ�������п�����NaCl��NaClO��NaClO3����![]() ��ֵ�����¶ȸߵ��йأ���n(NaOH)��6a molʱ�������й�˵����ȷ����
��ֵ�����¶ȸߵ��йأ���n(NaOH)��6a molʱ�������й�˵����ȷ����
A. �ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���n�ķ�Χ��3a mol��n��5a mol
B. �ı��¶ȣ�������NaCl����С���۲���Ϊ4a mol
C. �μӷ�Ӧ�����������ʵ���Ϊ6a mol
D. ij�¶��£�����Ӧ��![]() ��6������Һ��
��6������Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̽��������ˮ�ɷּ����ʵ�ʵ���У��������з������������ܵó���Ӧ���۵���
���� | ���� | ���� | |
A | �۲���ˮ��ɫ | ��ˮ�ʻ���ɫ | ��ˮ�к�Cl2 |
B | ��NaHCO3��Һ�м���������ˮ | ����ɫ������� | ��ˮ�к�HClO |
C | ���ɫֽ���ϵμ���ˮ | ��ɫֽ����ɫ | ��ˮ����Ư���� |
D | ��FeCl2��Һ�еμ���ˮ | ��Һ����ػ�ɫ | ��ˮ���������� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ��
A. �������ƹ�����ˮ��Ӧ��2O22-+2H2O=4OH-+O2��
B. ������[KAl(SO4)2]��Һ����μ���Ba(OH)2��Һ��SO42-ǡ�ó�����ȫ��2Al3++3SO42-+3Ba2++6OH- =2Al(OH)3��+3BaSO4��
C. ��ͭ���缫���CuSO4��Һ��2Cu2++2H2O![]() 2Cu+O2��+4H+
2Cu+O2��+4H+
D. FeSO4������Һ��¶�ڿ����У�4Fe2++O2+4H+=4Fe3++2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����д���пհף�
(1)����6.02��1023��H��H2O�������ʵ�����_______��1 mol Na2SO4����ˮ�ܵ����______��Na����
(2)______mol H2O�к��е���ԭ������1.5 mol CO2�к��е���ԭ������ȡ�
(3)�������ʵ�����NH3��CH4��ϣ����������NH3��CH4��������Ϊ________��
(4)��״���£��ܶ�Ϊ0.75 g��L��1��NH3��CH4��ɵĻ�������У�NH3���������Ϊ__________���û�����������������ܶ�Ϊ________��
(5)��֪a g A��b g Bǡ����ȫ��Ӧ����0.2 mol C��d g D����C��Ħ������Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���ͭ�ɳ���أ�����ԭ������ͼ���ڸõ���У���ˮϵ���Һ��ˮϵ���Һ������ӹ��������մ�Ƭ(Li+����Ĥ)����������˵������ȷ����

A. �մ�Ƭ����Li+ͨ����������ˮ����ͨ��
B. �ŵ�ʱ��N��Ϊ��ص�����
C. ���ʱ��������ӦΪ:Cu-2e-== Cu2+
D. ���ʱ��������AӦ����ӵ�Դ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
�� SO2+2H2O+I2===H2SO4+2HI �� 2HI![]() H2+I2 �� 2H2SO4 === 2SO2+O2+2H2O
H2+I2 �� 2H2SO4 === 2SO2+O2+2H2O
��1������������SO2��I2��������______��
��2��һ���¶��£���1L�ܱ������м���1mol HI��g����������Ӧ�ڣ���֪H2�����ʵ�����ʱ��ı仯��ͼ��ʾ������0~2 min�ڵ�ƽ����Ӧ����v (HI) =______��
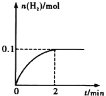
��3����֪��1 mol H��I����Ҫ����298kJ�������γ�1mol H��H���ܹ��ͷ�436kJ�������γ�1mol I��I���ܹ��ͷ�151kJ���������ڷ�Ӧ���У��ֽ�0.2mol HIʱ��______������ա����ͷš���______kJ������
��4��ʵ������Zn��������H2��Ϊ�˼ӿ췴Ӧ�������д�ʩ����������__������ţ�
a������Ũ���� b����������CuSO4 ���� c���ô�п���洿п d������ e����п��Ū��п�� f����98.3%��Ũ����
��5��������������ȼ�ϵ�أ�ij������ȼ�ϵ�����ù�������������մ�������ʣ������Ϸ����ĵ缫��Ӧ�ֱ�Ϊ��A����2H2��2O2����4e��== 2H2O ��B����O2��4e��== 2O2������A���ǵ�ص�___�������ӴӸü�___������롱������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʮ�����Ǿ��иߴ����ܶȵ��������壬������ʮ������C10H18������������C10H12��������C10H8��������������ͷ���������֪��
C10H18(l)![]() C10H12(l)��3H2(g) ��H1
C10H12(l)��3H2(g) ��H1
C10H12(l)![]() C10H8(l)��2H2(g) ��H2
C10H8(l)��2H2(g) ��H2
��H1����H2��0��C10H18��C10H12�Ļ��ΪEa1��C10H12��C10H8�Ļ��ΪEa2��ʮ�����ij�ѹ�е�Ϊ192������192����Һ̬ʮ���������ⷴӦ��ƽ��ת����ԼΪ9������ش�
��1�����������������Ӧƽ��ת���ʵ�������_________��
A�����¸�ѹ B�����µ�ѹ C�����µ�ѹ D�����¸�ѹ
��2���о���������������ʮ�������ں����ܱշ�Ӧ���У������¶ȴ�����ѹ����������Ҳ���������⣬������______________________________________________________��
��3���¶�335�����ں����ܱշ�Ӧ���н��и�ѹҺ̬ʮ������1.00 mol��������ʵ�飬���C10H12��C10H8�IJ���x1��x2�������ʵ��������ƣ���ʱ��仯��ϵ����ͼ1��ʾ��
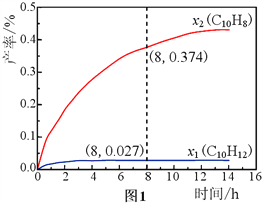

����8 hʱ����Ӧ��ϵ����������Ϊ__________mol��������������Ӧ����
��x1��������x2��ԭ����________________________________________��
����ͼ2�л�����C10H18��C10H12��C10H8��������������Ӧ������ʾ��ͼ��
������ѧ�ҷ��֣���H2O��N2Ϊԭ�ϣ�����NaOH��KOHΪ����ʣ�����Fe2O3����������250���ͳ�ѹ�¿�ʵ�ֵ绯ѧ�ϳɰ��������������ı仯����Ϊ���������У��벹��������
��4���缫��Ӧʽ��________________________________��2Fe��3H2O��N2��Fe2O3��2NH3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A. ![]() C��ʾ������Ϊ6��������Ϊ8�ĺ���
C��ʾ������Ϊ6��������Ϊ8�ĺ���
B. �״�(CH3OH)����(CH2OHCHOHCH2OH)��Ϊͬϵ��
C. C5H12��ͬ���칹����3������е������ͬ
D. CH3CH2CH2CH(CH3)2��������2������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com