
【题目】一种锂铜可充电电池,工作原理如下图。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(Li+交换膜)隔开。下列说法不正确的是

A. 陶瓷片允许Li+通过,不允许水分子通过
B. 放电时,N极为电池的正极
C. 充电时,阳极反应为:Cu-2e-== Cu2+
D. 充电时,接线柱A应与外接电源的正极相连
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH)+c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示。
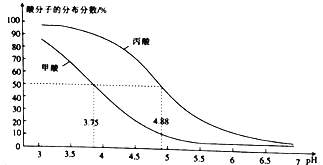
下列说法正确的是
A. 丙酸的酸性比甲酸强
B. CH3CH2COOH![]() CH3CH2COO-+H+的lgK=-4.88
CH3CH2COO-+H+的lgK=-4.88
C. 若0.1mol/L甲酸溶液的pH=2.33,则0.01mol/L甲酸溶液的pH=3.33
D. 将0.1mol/L的HCOOH溶液与0.1mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解等,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1,则该温度下水的离子积常数KW=_______;该温度下,pH=10的Ba(OH)2溶液的物质的量浓度为_________。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度由大到小顺序为______(用序号回答)。
(3)25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=__________,则a_______ b(填“﹥”、“﹤”或“=”)。
(4)将AgCl分别放入:①5 mL水 ②10 mL 0.1 mol·L-1 MgCl2溶液 ③20 mL 0.5 mol·L-1 NaCl溶液 ④40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、 c、d,它们由大到小的排列顺序是_____(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.1g平均相对分子质量为7.2的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
A. 2.1g B. 3.6g C. 7.2g D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:
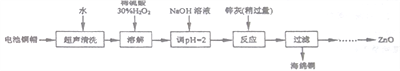
(1)①铜帽溶解时加入H2O2的目的是___________________(用化学方程式表示)。
②铜帽溶解后需将溶液中过量H2O2除去。除去H2O2的简便方法是_________________。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为_____________,滴定终点观察到的现象为_________________。
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会__________(填“偏高”“ 偏低”“ 不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Fe 2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0mol·L-1HNO3、1.0mol·L-1NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为:
①向滤液中加入___________使其充分反应;②滴加1.0mol·L-1的氢氧化钠,调节3.2≤pH<5.9,使___________沉淀完全;③过滤;④向滤液中滴加1.0 mol·L-1的氢氧化钠,调节pH为________≤pH≤_______,使Zn2+沉淀完全,⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在密闭容器中合成氨反应如下:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,下列叙述正确的是
2NH3(g) ΔH=-92.4 kJ/mol,下列叙述正确的是
A. 混合气体的质量不变时,说明该反应一定达到平衡状态
B. 将容器的体积扩大到原来的2倍,v(正)减小,v(逆)增大,平衡向左移动
C. 1mol N2(g)和3 mol H2(g)的总键能大于2 mol NH3(g)的总键能
D. 在密闭容器中通入1mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为:N2O(g)+CO(g)![]() CO2(g)+N2(g)ΔH,有关化学反应的物质变化过程如图1,能量变化过程如图2。下列说法正确的是
CO2(g)+N2(g)ΔH,有关化学反应的物质变化过程如图1,能量变化过程如图2。下列说法正确的是
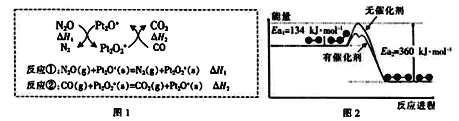
A. 由图1可知:ΔH1=ΔH+ΔH2
B. 由图2可知:ΔH=-226kJ/mol
C. 由图2可知:反应①的反应速率比反应②快
D. 为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是
选项 | 实验 | 现象 |
A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向Al2(SO4)3溶液中滴加过量NaOH溶液 | 产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( )

A. W、Y、X三种元素的原子半径依次减小
B. Z元素的气态氢化物的热稳定性比Y的高
C. W元素与氢元素可能会形成W2H6
D. Y元素的单质能从NaZ溶液中置换出Z元素的单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com