
【题目】已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且![]() 的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是
的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是
A. 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol
B. 改变温度,产物中NaCl的最小理论产量为4a mol
C. 参加反应的氯气的物质的量为6a mol
D. 某温度下,若反应后![]() =6,则溶液中
=6,则溶液中![]()
【答案】A
【解析】
A.氧化产物只有NaClO3时,转移电子最多,氧化产物只有NaClO时,转移电子最少,根据电子转移守恒及钠离子守恒计算;B.反应中转移电子最少时生成NaCl最少;C.由Cl原子守恒可以知道:2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3);由钠离子守恒可以知道: n(NaCl)+n(NaClO)+n(NaClO3)=n(NaOH);D.令n(ClO-)=1mol,反应后c(Cl-)/c(ClO-)=6,则n(Cl-)=6mol ,根据电子转移守恒计算n(ClO3-),据此计算判断。
A.氧化产物只有NaClO3时,转移电子最多,根据电子转移守恒n(NaCl)=5 n(NaClO3),由钠离子守恒: n(NaCl)+ n(NaClO3)=n(NaOH) ,故n(NaClO3)=1/6 n(NaOH)=1/6×6amol= a mol,转移电子最大物质的量=a×5=5a mol;氧化产物只有NaClO时,转移电子最少,根据电子转移守恒n(NaCl)= n(NaClO),由钠离子守恒: n(NaCl)+n(NaClO) = n(NaOH) ,故n(NaClO)=1/2n(NaOH)=3a mol,转移电子最小物质的量=3a×1=3a mol,故反应中转移电子的物质的量n的范围: 3a mol≤n≤5a mol,A正确;B.反应中还原产物只有NaCl,反应中转移电子最少时生成NaCl最少,根据电子转移守恒n(NaCl)= n(NaClO),由钠离子守恒: n(NaCl)+ n(NaClO) = n(NaOH) ,故n(NaClO)=1/2n(NaOH)=3amol,B错误;C.由Cl原子守恒可以知道, 2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3),由钠离子守恒可以知道n(NaCl)+n(NaClO)+n(NaClO3)=n(NaOH),故参加反应的氯气的物质的量=1/2 n(NaOH)=3amol,C错误;D.令n(ClO-)=1mol,反应后c(Cl-)/c(ClO-)=6,则n(Cl-)=6mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即5× n(ClO3-)+1=1×6,计算得出n(ClO3-)=1mol,则溶液中c(Cl-)/c(ClO3-)=6,D错误;正确选项A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法正确的是
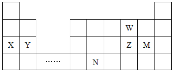
A. 简单氢化物的熔沸点W>Z,是因为W的非金属性强
B. 单核离子的半径:Y2+>X+
C. 溴与元素M同主族,最高价氧化物对应的水化物酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl,利用如下反应,可实现氯的循环利用:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H=﹣115.6kJ/mol
2Cl2(g)+2H2O(g)△H=﹣115.6kJ/mol

下列说法正确的是
A. 该反应的活化能为115.6kJ/mol
B. 加入催化剂,能使该反应的焓变增大
C. 该反应的正反应活化能比逆反应活化能大
D. 断裂H2O(g)中1molH-O键比断裂HCl(g)中1molH-Cl键所需能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物![]() (W是链接中的部分结构)是一类重要的功能高分子材料.聚合物是其中的一种,转化路线如下:
(W是链接中的部分结构)是一类重要的功能高分子材料.聚合物是其中的一种,转化路线如下:

已知:①A中官能团不在同一个碳原子上。
②![]()
③R1CH=CHR2+R3CH=CHR4![]() R1CH=CHR4+R2CH=CHR3(R表示烃基或氢原子)。
R1CH=CHR4+R2CH=CHR3(R表示烃基或氢原子)。
(1)B所含的官能团名称是__________。
(2)E的名称是__________,G生成H的反应类型是__________。
(3)写出D生成E的化学方程式是______________________。
(4)X的结构简式_______________。
(5)E存在多秧同分异构体,与E具有相同官能团且不能发生银镜反应的同分异构体有__________种(不考虑立体结构,不含E)。其中符合核磁共振氢谱中峰面积之比3:3:2 的结构简式________________________。
(6)以CH3CH2OH为原料(无机试剂任选)合成环丁烯,试写出合成流程图______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
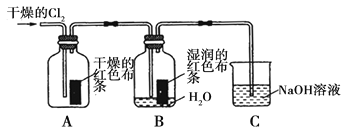
①通入Cl2 后,观察到的现象是 根据现象可得出的结论是 。
②集气瓶B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
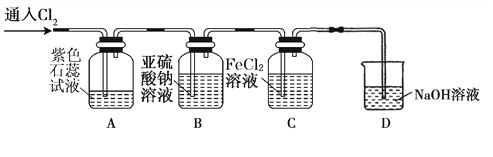
①实验开始后,观察装置A 中的现象是 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生 反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH)+c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示。
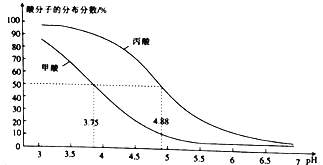
下列说法正确的是
A. 丙酸的酸性比甲酸强
B. CH3CH2COOH![]() CH3CH2COO-+H+的lgK=-4.88
CH3CH2COO-+H+的lgK=-4.88
C. 若0.1mol/L甲酸溶液的pH=2.33,则0.01mol/L甲酸溶液的pH=3.33
D. 将0.1mol/L的HCOOH溶液与0.1mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在一定量0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列说法不正确的是( )

A. a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
B. Ksp[Al(OH3)]=10-32
C. c~d段,溶液中离子浓度的关系为:c(Na+)+ c(H+)+ 3c(Al3+)= c(OH-)+c(AlO2-)
D. d点时,溶液中离子浓度的大小关系为:c(Na+)>c(AlO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
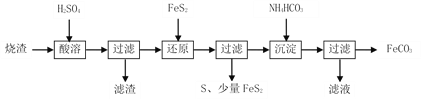
(1)“酸溶”时加快反应速率的方法有___________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___________;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g。则Fe2O3的质量为______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:
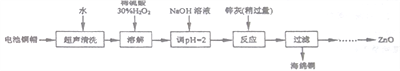
(1)①铜帽溶解时加入H2O2的目的是___________________(用化学方程式表示)。
②铜帽溶解后需将溶液中过量H2O2除去。除去H2O2的简便方法是_________________。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为_____________,滴定终点观察到的现象为_________________。
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会__________(填“偏高”“ 偏低”“ 不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Fe 2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0mol·L-1HNO3、1.0mol·L-1NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为:
①向滤液中加入___________使其充分反应;②滴加1.0mol·L-1的氢氧化钠,调节3.2≤pH<5.9,使___________沉淀完全;③过滤;④向滤液中滴加1.0 mol·L-1的氢氧化钠,调节pH为________≤pH≤_______,使Zn2+沉淀完全,⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com