
【题目】I.常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表。
序号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)根据①组实验情况,分析混合溶液的pH=9的原因是______________________(用离子方程式表示),在该溶液中下列关系式错误的是________________(填标号)。
a.c(Na+)+c(H+)=c(OH-)+c(A-) b.c(Na+)=c(HA)+c(A-)
c.c(HA)+c(H+)=c(OH-) d.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c______0.2(填“>”“<”或“=”,下同),混合溶液中:c(A-)_______c(Na+)。
(3)从③组实验结果分析,说明HA的电离程度_____NaA的水解程度(填“>”“<”或“=”),离子浓度由大到小的顺序是_______________________________。
Ⅱ.室温下,若将0.1 molL-1盐酸滴入20mL0.1 molL-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示:

(1)NH3·H2O的电离方程式是_______________________________。
(2)b点所示溶液中的溶质是_______________________________。
(3)c点所示溶液中,离子浓度从大到小的关系为_______________________________。
【答案】 A-+H2O![]() HA+OH- d > = > c(A-)>c(Na+)>c(H+)>c(OH-) NH3·H2O
HA+OH- d > = > c(A-)>c(Na+)>c(H+)>c(OH-) NH3·H2O![]() NH4++OH- NH4Cl 和NH3·H2O c(Cl-)>c(NH4+)>c(H+)>c(OH-)
NH4++OH- NH4Cl 和NH3·H2O c(Cl-)>c(NH4+)>c(H+)>c(OH-)
【解析】试题分析:Ⅰ、(1)HA与NaOH等体积、等浓度混合,恰好反应生成NaA,若NaA是强碱弱酸盐,A-水解溶液显碱性,所以PH>9,则混合溶液的pH=9的原因是A-+H2O![]() HA-+OH-;A.根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),正确;B.根据物料守恒,c(Na+)=c(HA)+c(A-)正确;C.根据质子守恒c(HA)+c(H+)=c(OH-),正确;选D。
HA-+OH-;A.根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),正确;B.根据物料守恒,c(Na+)=c(HA)+c(A-)正确;C.根据质子守恒c(HA)+c(H+)=c(OH-),正确;选D。
(2)NaA溶液呈碱性,要使混合溶液呈中性,则HA应该稍微过量,二者体积相等,所以c>0.2molL-1,根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(A-),c(H+)=c(OH-),则c(A-)=(Na+)。
(3)从③组实验结果可以看出,等物质的量浓度的NaA和HA溶液呈酸性,说明酸的电离程度大于酸根离子水解程度,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(A-)>c(Na+),溶液中酸的电离较微弱,所以c(Na+)>c(H+),则溶液中离子浓度大小顺序是c(A-)>c(Na+)>c(H+)>c(OH-)。
Ⅱ、(1)NH3·H2O是弱碱,电离方程式是NH3·H2O![]() NH
NH![]() +OH–,
+OH–,
(2)等浓度等体积的氨水和HCl恰好反应,生成NH4Cl ,NH4Cl 属于强酸弱碱盐,水解显酸性。要想使溶液显中性,氨水需多加点,则b点所示溶液中的溶质是NH4Cl和NH3·H2O;
(3)c点所示的溶液是等浓度等体积的氨水和HCl恰好反应,生成的氯化铵水解显酸性,离子浓度从大到小的关系为c (Cl–) >c (NH4+)>c (H+)>c (OH–)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA
B. 4.6 g NO2和N2O4混合物中含氧原子数为0.3 NA
C. 标准状况下,6.72 L NO2与水反应,转移电子数为0.3 NA
D. 0.1 mol/L NaHCO3溶液中,HCO3-、H2CO3和CO32-总数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL 2 mol·L-1 HNO3溶液中,逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe2+)随n(Fe)变化如右图所示。下列有关说法正确的是

A. 当0<n(Fe)≤b时,向所得的溶液中加入KSCN溶液没有血红色出现
B. 向c点处的反应液中加入稀盐酸后无明显现象
C. 当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol
D. 图中a=0.15 、b =0.15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O3·5H2O,实验室用如下装置(略去部分夹持仪器)模拟生成过程。
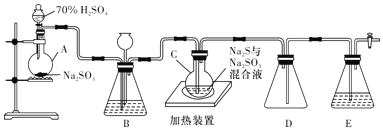
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若____________,则整个装置气密性良好,装理D的作用是___________。装置E中为_________________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则理论上烧瓶C中Na2S和Na2SO3的物质的量之比为____________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择__________(填字母代号)。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是___________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是____________________________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器有_____________。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O35H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:__________________________________。(已知Na2S2O35H2O遇酸易分解:S2O32- + 2H+ =S↓+ SO2↑+ H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。
2PbSO4+2H2O。

(1)放电时,正极的电极反应式是___________________________,电解液中H2SO4的浓度逐渐________________,当外电路通过1mol电子时,理论上负极板的质量增加________________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接电解,则在A电极的电极反应式是___________________, B电极的电极反应式是____________________,电解后铅蓄电池的正、负极的极性将______________ (填“改变”或“不改变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲烷分子的比例模型为![]() ,其二氯取代物有2种结构
,其二氯取代物有2种结构
B. 苯和乙烯都能使溴水褪色,其褪色原理相同
C. 相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同
D. 在一定条件下,苯与氯气生成氯苯的反应类型是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:
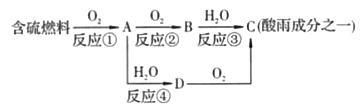
回答下列问题:
①酸雨的pH________(填“>”“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为___________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:____________,反应中氧化剂是___________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组从甲苯出发,按下列路线合成染料中间体X和医药中间体Y。

已知:①化合物A、E、F互为同分异构体。

请回答:
(1)下列说法不正确的是_____________。
A.化合物C能发生氧化反应,不发生还原反应 B.化合物D能发生水解反应
C.化合物E能发生取代反应 D.化合物F能形成内盐
(2)B+C→D的化学方程式是____________________________________________。
(3)化合物G的结构简式是___________________。
(4)写出同时符合下列条件的A的所有同分异构体的结构筒式___________。
①红外光谱检测表明分子中含有醛基,②1H-NMR谱显示分子中含有苯环,目苯环上有两种不同化学环境的氢原子。
(5)为探索新的合成路线,采用苯和乙烯为原料制备化台物F,请设计该合成路线(用流程图表示,无机试剂任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等VA族元素化合物在研究和生产中有重要用途。如我国科研人员研究发现As2O3(或写成As4O6,俗称砒霜)对白血病有明显的治疗作用回答下列问题:
(1)As原子的核外电子排布式为_________________;P的第一电离能比S大的原因为_______________
(2)写出一种与CNˉ互为等电子体的粒子________(用化学式表示);(SCN)2分子中σ键和π键个数比为___________
(3)砒霜剧毒,可用石灰消毒生成AsO33-和少量AsO43-,其中AsO33-中As的杂化方式为__________,AsO43-的空间构型为___________
(4)NH4+中H一N一H的键角比NH3中H 一N一H的键角大的原因是__________;NH3和水分子与铜离子形成的化合物中阳离子呈轴向狭长的八面体结构(如下图I),该化合物加热时首先失去水,请从原子结构角度加以分析:__________
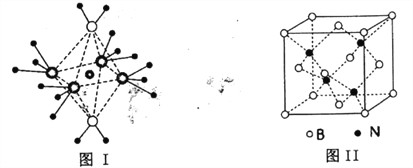
(5)BN的熔点为3000℃,密度为2.25g·cm-3,其晶胞结构如上图Ⅱ所示,晶体中一个B原子周围距离最近的N原子有__________个;若原子半径分别为rNpm和rBpm,阿伏加德罗常数值为NA,则BN晶胞中原子的体积占晶胞体积的百分率为__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com