
【题目】工业上常利用含硫废水生产Na2S2O3·5H2O,实验室用如下装置(略去部分夹持仪器)模拟生成过程。
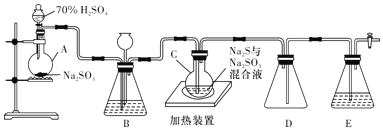
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若____________,则整个装置气密性良好,装理D的作用是___________。装置E中为_________________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则理论上烧瓶C中Na2S和Na2SO3的物质的量之比为____________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择__________(填字母代号)。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是___________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是____________________________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器有_____________。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O35H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:__________________________________。(已知Na2S2O35H2O遇酸易分解:S2O32- + 2H+ =S↓+ SO2↑+ H2O)
【答案】(18分)答案:(1)液柱高度保持不变;防止倒吸;NaOH(合理即得分)
(2)2:1
(3)c 控制滴加硫酸的速度(合理即得分)
溶液变澄清(或混浊消失);
a、d
(4)取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质。(合理即得分)
【解析】
试题(1)液柱高度保持不变,说明气密性良好;D为安全瓶,可以防止倒吸;装置E起到吸收为期中二氧化硫和硫化氢的作用,所以选用NaOH。(2)根据题目给的3个反应,可以得到关系为2Na2S-2H2S-3S-3Na2SO3,所以烧瓶C中硫化钠和亚硫酸钠的物质的量比为2:1。(3)二氧化硫易溶于水,能与亚硫酸钠溶液和碳酸氢钠溶液反应,但在亚硫酸氢钠溶液中溶解度小,所以选c;二氧化硫为70%硫酸和亚硫酸钠反应制取的,所以为了使二氧化硫缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度。反应(III)相对较慢,所以烧瓶C的反应终点的现象为溶液变澄清(或混浊消失);蒸发皿和试管可以直接加热,烧杯和锥形瓶加热时需要使用石棉网,所以选a、d。(4)检验溶液中的硫酸根即可,方法为取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质。
离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
CO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出无色无味气体 | Ba2++CO32-=BaCO3↓ |
②稀盐酸、Ca(OH)2溶液 | 加入稀盐酸后放出的气体通入使澄清的Ca(OH)2溶液 | 加入稀盐酸后放出无色无味气体,通入澄清的Ca(OH)2溶液变浑浊 | CO32-+2H+=H2O+CO2↑ | |
SO42- | BaCl2溶液、稀硝酸或稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ba2++SO42-=BaSO4↓ |
SO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出刺激性气味的气体 | SO32-+2H+=H2O+SO2↑ |
②稀盐酸、品红溶液 | 加入稀盐酸后放出的气体通入品红溶液 | 加入稀盐酸后放出的气体使品红溶液褪色 | SO32-+2H+=H2O+SO2↑ | |
Cl- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ag++Cl-=AgCl↓ |
Br- | AgNO3溶液、稀硝酸或稀盐酸 | 生成不溶于稀硝酸或稀盐酸的浅黄色沉淀 | Ag++Br-=AgBr↓ | |
I- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸的黄色沉淀 | Ag++I-=AgI↓ |
②新制氯水,淀粉溶液 | 向未知溶液中加入新制氯水,再加入淀粉溶液 | 滴入新制Cl2,振荡后再滴入淀粉溶液,变蓝 | Ag++I-="AgI↓" 2I-+Cl2=I2+2Cl-I2遇淀粉变蓝 |


科目:高中化学 来源: 题型:
【题目】在3Cl2+6KOH![]() KClO3+5KCl+3H2O的反应中,下列说法不正确的是 ( )
KClO3+5KCl+3H2O的反应中,下列说法不正确的是 ( )
A. Cl2是氧化剂,KOH是还原剂
B. KCl是还原产物,KClO3是氧化产物
C. 反应中每消耗3 mol Cl2,转移电子数为5NA
D. 被还原的氯气的物质的量是被氧化的氯气的物质的量的5倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将反应2Fe3++2I-=2Fe2++I2设计成下图所示的原电池:

实验步骤及现象如下:
①闭合开关,指针发生偏转,随后电流计读数逐渐变小,当读数变为零时,打开开关;
②取少许甲烧杯中溶液,滴入3~4滴淀粉溶液,溶液显蓝色;
③取少许乙烧杯中溶液,滴入3~4滴KSCN溶液,溶液显血红色;
④向乙烧杯中加入少量FeCl2固体,再次闭合开关,指针向左偏转(最后读数变为零)。
【查阅资料】灵敏电流计指针总是偏向电源正极;原电池中存在内阻,会影响反应进程。
请回答:
(1)步骤①中,开始时指针向_____(填“左"或“右”)偏转,甲烧杯中发生的电极反应式____________________。
(2)经步骤①后,乙烧杯溶液中新增金属阳离子____________(填离子符号)。
(3)步骤④中指针向左偏转,乙烧杯中发生的电极反应式______________________。
(4)要证明2Fe3++2I-![]() 2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是______________(填序号)。
2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是______________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗氢氧化钾溶液,其工作原理如图所示。下列说法错误的是

A. 电解过程中,阴极区溶液的pH增大
B. 电解过程中,K+通过阳离子交换膜从阴极区移向阳极区
C. 电解过程中,阳极可发生反应:4OH--4e-==2H2O+O2↑
D. 纯氢氧化钾溶液从b出口导出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. Zn+2HCl===ZnCl2+H2↑
B. Ca(ClO)2+2HCl===CaCl2+2HClO
C. Pb3O4+8HCl(浓)===3PbCl2+Cl2↑+4H2O
D. 3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表。
序号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)根据①组实验情况,分析混合溶液的pH=9的原因是______________________(用离子方程式表示),在该溶液中下列关系式错误的是________________(填标号)。
a.c(Na+)+c(H+)=c(OH-)+c(A-) b.c(Na+)=c(HA)+c(A-)
c.c(HA)+c(H+)=c(OH-) d.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c______0.2(填“>”“<”或“=”,下同),混合溶液中:c(A-)_______c(Na+)。
(3)从③组实验结果分析,说明HA的电离程度_____NaA的水解程度(填“>”“<”或“=”),离子浓度由大到小的顺序是_______________________________。
Ⅱ.室温下,若将0.1 molL-1盐酸滴入20mL0.1 molL-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示:

(1)NH3·H2O的电离方程式是_______________________________。
(2)b点所示溶液中的溶质是_______________________________。
(3)c点所示溶液中,离子浓度从大到小的关系为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的过氧化钠,可利用的装置如下图所示。
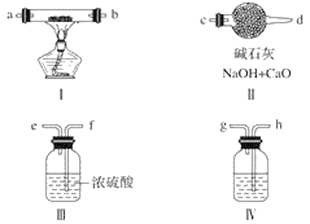
请回答下列问题:
(1)装置Ⅳ中盛放的药品是______________,其作用是______________。
(2)若规定气体的气流方向从左到右,则组合实验装置时各件仪器的正确连接顺序为(按从左到右顺序写明仪器的编号Ⅰ、Ⅱ……)______________,各仪器接口的标号字母(a、b……)顺序是空气进入__________,接__________,接__________,接__________。______________
(3)装置Ⅱ的作用是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
①0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”)
②若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
A.[H+]>[HC2O4-]>[HCO3-]>[CO32-] B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
C.[H+]>[HC2O4-]>[C2O42-]>[CO32-] D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(2)白磷与氧气可发生如下反应:P4+5O2= P4O10。已知断裂下列化学键需要吸收的能量分别为: P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH=___________。

(3)25 ℃,某浓度的盐酸、氯化铵溶液中由水电离出的氢离子浓度分别为1.0×10-amol·L-1、1.0×10-b mol·L-1,这两种溶液的pH之和=___________。
(4)在t ℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示:
序号 | 氢氧化钡溶液 的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com