
【题目】某溶液中含有HCO3﹣、SO32﹣、CO32﹣、CH3COO﹣种阴离子.若向其中加入足量的Na2O2后,溶液中离子浓度基本保持不变的是( )
A.CH3COO﹣
B.SO32﹣
C.CO32﹣
D.HCO3﹣
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以下是元素周期表的一部分,回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
4 |
|
|
(1)与水反应最剧烈的金属元素是_____;元素构成的最稳定气态氢化物的化学式是_________;③、④、⑧元素原子半径由大到小是_____________(用元素符号表示).
(2)写出元素⑦的单质与⑥最高价氧化物的水化物反应的离子方程式______________.
(3)②、④两种元素形成某气体化合物是导致温室效应的主要原因,该化合物的电子式为_____________;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程______________________.
(4)②的单质与⑨的最高价氧化物的水化物的浓溶液反应化学方程式____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】在研究金矿床物质组分的过程中,通过分析发现了Cu-Ni-Zn-Sn-Fe多金属互化物。
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于 (填“晶体”或“非晶体”),可通过 方法鉴别。
(2)基态Ni2+的核外电子排布式 ;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”)。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为 ;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是 ;写出一种与SCN—互为等电子体的分子 (用化学式表示)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为 。
![]()
(5)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为 g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)。人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为 。
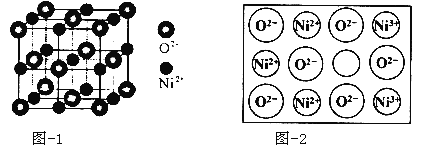
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5 OH﹣═FeO42﹣+4H2O
C.放电时正极附近溶液的碱性增强
D.放电时负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属晶体的叙述正确的是
A.用铂金做首饰不能用金属键理论解释
B.固态和熔融时易导电,熔点在1000℃左右的晶体可能是金属晶体
C.Li、Na、K的熔点逐渐升高
D.金属导电和熔融电解质(或电解质溶液)导电的原理一样。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是_____________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是____________________。再由a向c中加2 mL蒸馏水,c中的实验现象是 ___________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____________。理由是_____________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钙在2973 K时熔化,而NaCl在1074 K时熔化,二者的离子间距和晶体结构都类似,有关它们熔点差别较大的原因叙述不正确的是
A.氧化钙晶体中阴、阳离子所带电荷数多
B.氧化钙晶格能比氯化钠的晶格能大
C.两种晶体的晶胞结构类型不同
D.氧化钙、氯化钠的离子间距类似情况下,晶格能主要由阴、阳离子所带电荷数决定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知ΔH 表示反应热(ΔH>0表示吸热,ΔH<0表示放热),下列描述正确的是( )
A.伴随有能量变化的物质变化都是化学变化。
B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同。
C.已知相同条件下2SO2(g)+O2(g)![]() 2SO3(g) ΔH1,反应2SO2(s)+O2(g)
2SO3(g) ΔH1,反应2SO2(s)+O2(g)![]() 2SO3(g) ΔH2,则ΔH1>ΔH2。
2SO3(g) ΔH2,则ΔH1>ΔH2。
D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓H2SO4与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com