
【题目】某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。

已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
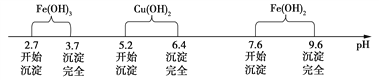
请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是________(填序号)。
(2)溶液A中所含溶质为________;物质X应选用________(填序号)。
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(3)从溶液C中制取硫酸铜晶体的实验操作为______________________________。
(4)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:(已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )
)
滴定次数 | 第一次 | 第二次 | 第三次 |
滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
①CuSO4溶液与KI的反应的离子方程式为______________________________。
②滴定中,Na2S2O3标准溶液应放在________(填“酸式滴定管”或“碱式滴定管”)中,滴定终点的现象是______________________________。
③溶液A中c(Cu2+)=________mol·L-1。
【答案】 ①③ CuSO4、FeSO4、H2SO4 ② 蒸发浓缩、冷却结晶、过滤 2Cu2++4I-===2CuI↓+I2 碱式滴定管 最后一滴标准液滴入,溶液由蓝色变为无色,振荡,半分钟内溶液无明显变化 0.5000
【解析】 (1)在整个实验过程中,实验中用到的化学操作有称量、过滤和蒸发,灼烧,没有制取气体、分液操作;正确选项①③。
(2) 氧化铜和氧化亚铁分别与硫酸反应生成硫酸铜和硫酸亚铁,又硫酸过量,则溶质A的主要成分为:CuSO4、FeSO4、H2SO4;根据实验流程可以知道,测量氧化铜含量,需要获得纯净的硫酸铜晶体,应该先除去亚杂质铁离子、铁离子,因为亚铁离子完全沉淀的pH=9.6, 此时铜离子也完全沉淀,而铁离子完全沉淀的pH=3.7, 此时铜离子没有生成沉淀,所以应该加入X将亚铁离子氧化成铁离子,并且选用的氧化剂不能引进杂质离子,不能产生污染大气的气体,所以应该选用②双氧水,符合要求;铁粉具有还原性,氯水、高锰酸钾具有氧化性,但引入新的杂质;正确答案:CuSO4、FeSO4、H2SO4 ;②。
(3)通过对硫酸铜溶液进行蒸发浓缩、冷却结晶、过滤可以得到硫酸铜晶体;正确答案:蒸发浓缩、冷却结晶、过滤。
(4)①CuSO4与KI反应生成碘单质、碘化亚铜、硫酸钾,离子反应为2Cu2++4I-=2CuI↓+I2;正确答案:2Cu2++4I-=2CuI↓+I2。
②Na2S2O3属于强碱弱酸盐,溶液呈碱性,应用碱式滴定管盛放;淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变,说明滴定到达终点;正确答案:碱式滴定管 ;最后一滴标准液滴入,溶液由蓝色变为无色,振荡,半分钟内溶液无明显变化。
③三次滴定消耗的标准液的体积分别为:(20.12-0.10)mL=20.02mL、(20.34-0.36)mL=19.98mL、(22.12-1.10)mL=21.02mL,前两组数据有效,所以平均体积为:20.00mL,由2Cu2++4I-=2CuI↓+I2、I2+2S2O32-=S4O62-+2I-可知,Cu2+~S2O32-,因移取10.00mL溶液A于100mL容量瓶,加水定容至100mL,取稀释后试液20.00mL于锥形瓶中,所以c(Cu2+)=[0.05×0.02×5]/0.01=0.5000 mol/L;正确答案:0.5000。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】以赤铁矿(主要成分为60.0%Fe2O3,杂质有3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:
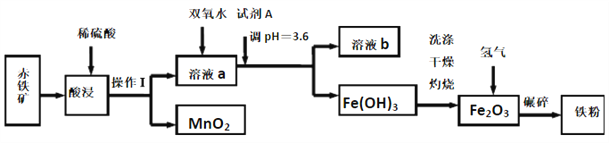
已知部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表所示, 请回答下列问题:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Cu(OH)2 |
pH | 3.4 | 5.2 | 9.7 | 6.7 |
(1)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是____________________________。
(2)将pH控制在3.6的目的是_______。已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O![]() Cu(OH)2+2H+的平衡常数K=_______。
Cu(OH)2+2H+的平衡常数K=_______。
(3)加入双氧水时反应的离子方程式为_______。
(4)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexNy),若消耗氨气17.0g,消耗赤铁矿石1Kg,写出该反应完整的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把表面有氧化膜的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中金属离子为
A.Fe3+和Cu2+B.Fe2+和Cu2+C.Fe3+和Fe2+D.只有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液中分别加入足量氨水,观察到的现象相同的是
A.FeCl3、AlCl3B.FeCl3、FeSO4C.NaNO3、BaCl2D.MgSO4、CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。下列说法正确的是( )

A. 该硫酸的物质的量浓度为9.2 mol/L
B. 1 mol Fe与足量的该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol/L的硫酸需取该硫酸50 mL
D. 等质量的水与该硫酸混合后所得溶液的物质的量浓度大于9.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3、②NaHCO3、③HCl、④NH3·H2O
(1)上述溶液中,可发生水解的是______(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为:____________________________________。
(3)向④中加入少量氯化铵固体,此时c(NH![]() )/c(OH-)的值________(填“增大”、“减小”、或“不变”)。
)/c(OH-)的值________(填“增大”、“减小”、或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是____________。
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,只能表示一个化学反应的是( )
①Fe+Cu2+===Fe2++Cu
②Ba2++2OH-+2H++SO42—===BaSO4↓+2H2O
③Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
④CO32—+2H+===CO2↑+H2O
⑤Ag++Cl-===AgCl↓
A. 只有③ B. ②③ C. ③⑤ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是

A. H3AsO4![]() H2AsO4-+H+的电离常数为10-2.2
H2AsO4-+H+的电离常数为10-2.2
B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)
C. 水的电离程度:a>b>c
D. HAsO4-的水解程度大于电离程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com