
【题目】如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极 上析出6.4g某金属,下列说法正确的是
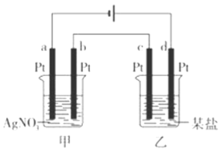
A.甲池是b极上析出金属银,乙池是c极上析出某金属
B.甲池是a极上析出金属银,乙池是d极上析出某金属
C.某盐溶液可能是CuSO4溶液
D.某盐溶液可能是Mg(NO3)2溶液
【答案】C
【解析】
甲池中a极与电源负极相连为阴极,电极上银离子得电子析出银单质,b电极为阳极,水电离出的氢氧根放电产生氧气,同时产生氢离子;乙池中c为阴极,d为阳极,乙池电极析出6.4g金属,金属应在c极析出,说明乙池中含有氧化性比氢离子强的金属阳离子。
A.甲池a极上析出金属银,乙池c极上析出某金属,故A错误;
B.甲池a极上析出金属银,乙池c极上析出某金属,故B错误;
C.乙池电极析出6.4g金属,说明乙池中含有氧化性比氢离子强的金属阳离子,Cu2+氧化性强于氢离子,会先于氢离子放电,则某盐溶液可能是CuSO4溶液,故C正确;
D.Mg2+氧化性较弱,电解时在溶液中不能得电子析出金属,所以某盐溶液不能是Mg(NO3)2溶液,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
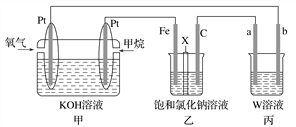
(1)石墨电极(C)作________极,甲中甲烷燃料电池的负极反应式为______________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为________ L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、An等杂质)的电解精炼。下列说法正确的是________(填字母)。
A.a电极为纯铜
B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变
D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在所给的条件下一定能够大量共存的是
A.在pH=0的溶液中:Fe2+、Mg2+、SO![]() 、Cl-
、Cl-
B.由水电离出的c(H+)=1×10-12mol/L的溶液中:NH![]() 、K+、Na+、NO
、K+、Na+、NO![]()
C.在A1C13溶液中:SO![]() 、Na+、CO
、Na+、CO![]() 、AlO
、AlO![]()
D.在滴加石蕊试液后呈红色的溶液中:I-、Na+、S2-、AlO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从植物花汁中提取的一种有机物HIn,可做酸、碱指示剂,在水溶液中存在电离平衡:HIn(红色)![]() H+ + In-(黄色)△H>0对上述平衡解释不正确的是
H+ + In-(黄色)△H>0对上述平衡解释不正确的是
A.升高温度平衡向正方向移动
B.加入盐酸后平衡向逆方向移动,溶液显红色
C.加入NaOH溶液后平衡向正方向移动,溶液显黄色
D.加入NaHSO4溶液后平衡向正方向移动,溶液显黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 某浓度的AlCl3溶液中滴入2 mol·L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
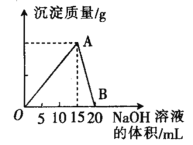
(1)图中A点表示的意义是______________。
(2)最大沉淀量是______________g。
(3)B点表示的意义是______________。
(4)所用AlCl3 溶液的物质的量浓度是______________。
(5)写出A~B段反应的离子方程式____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加徳罗常数的值,下列有关叙述正确的为
A.1 mol铁粉在1 mol氧气中充分燃烧,失去的电子数为3NA
B.标况下,3.36 LSO3含有的电子数为6NA
C.4.2 g乙烯和丙烯混合气中含有的极性键数目为0.6NA
D.1L 1mol/L的葡萄糖溶液中,含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用下列装置测定SO2催化氧化为SO3的转化率(部分夹持装置已省略,已知SO3的熔点为16.8℃,假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响),下列说法不正确的是( )
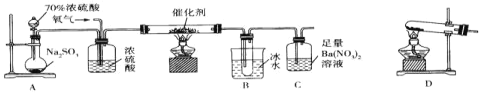
A.A装置烧瓶中发生的反应可以表示为SO32-+2H+=SO2↑+H2O
B.用D装置制备氧气,试管中的药品可以是KClO3
C.当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气
D.C中产生的白色沉淀是BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)![]() 2NO2(g),若N2O4的浓度由0.1mol·L-1降到0.07mol·L-1需要15s,那么N2O4的浓度由0.07mol·L-1降到0.05mol·L-1所需的反应时间( )
2NO2(g),若N2O4的浓度由0.1mol·L-1降到0.07mol·L-1需要15s,那么N2O4的浓度由0.07mol·L-1降到0.05mol·L-1所需的反应时间( )
A.等于5sB.等于10sC.小于10sD.大于10s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线![]() 部分反应条件略去
部分反应条件略去![]() 如图所示:
如图所示:
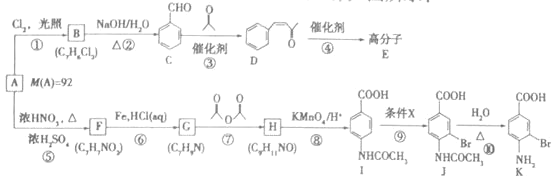
已知:
![]() 同一个碳原子上连两个羟基时不稳定,如
同一个碳原子上连两个羟基时不稳定,如
i.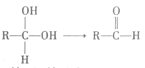 ii.
ii.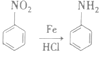
回答下列问题:
![]() 的名称是___________,I含有的官能团是____________。
的名称是___________,I含有的官能团是____________。
![]() 写出反应
写出反应![]() 的化学方程式:___________________。
的化学方程式:___________________。
![]() 的反应类型是_____________,
的反应类型是_____________,![]() 的反应类型是_____________。
的反应类型是_____________。
![]() 分子中最多有_____________个原子共平面,条件X为_______________。
分子中最多有_____________个原子共平面,条件X为_______________。
![]() 写出一种同时符合下列条件的F的同分异构体的结构简式____________________。
写出一种同时符合下列条件的F的同分异构体的结构简式____________________。
![]() 苯环上只有两种不同化学环境的氢原子
苯环上只有两种不同化学环境的氢原子
![]() 既能与银氨溶液反应又能与NaOH溶液反应
既能与银氨溶液反应又能与NaOH溶液反应
![]() 分子中只存在一个环状结构
分子中只存在一个环状结构
![]() 参照上述合成路线,设计一条由D为起始原料制备
参照上述合成路线,设计一条由D为起始原料制备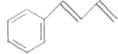 的合成路线
的合成路线![]() 无机试剂及溶剂任选
无机试剂及溶剂任选![]() 。__________________
。__________________
示例流程图如下: CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com