
����Ŀ������һ���Ȼ�����Ʒ�к�������̼��ء�����غͲ�����ˮ�����ʡ�Ϊ���ᴿ�Ȼ��أ��Ƚ���Ʒ��������ˮ�У���ֽ������ˣ��ٽ���Һ����ͼ��ʾ������в�����

�ش��������⣺
��1���Լ�I�Ļ�ѧʽΪ_______�������Լ�I�ٶ�Ӧ��ʵ�������______�����з�����Ӧ�����ӷ���ʽΪ________��
��2��������Һ�е� �Ƿ���SO42-�ķ�����______________________________________��
��3���Լ����Ļ�ѧʽΪ_______�����м����Լ�����Ŀ����__________��
��4���Լ�����������________�����з�����Ӧ�����ӷ���ʽΪ_________��
��5��ijͬѧ��ȡ�ᴿ�IJ�Ʒ0.745g���ܽ������100mL����ƿ�У�ȡ25.00mL��Һ����0.1000 mol��L![]() ������������Һ��Ӧ����Ӧ��������������Һ�����Ϊ23.50 mL���ò�Ʒ�Ĵ���Ϊ_________________��
������������Һ��Ӧ����Ӧ��������������Һ�����Ϊ23.50 mL���ò�Ʒ�Ĵ���Ϊ_________________��
���𰸡� BaCl2 ���� Ba2++SO42-=BaSO4 ����Ba2++CO32-=BaCO3�� ȡ������Һ���Թ��У������м���������ᣬ�ټ���BaCl2��Һ�����а�ɫ�������ɣ�����SO42-����֮���� K2CO3 ��ȥ�����Ba2+ ���� CO32-+2H+=CO2��+H2O 94%
����������1��Ҫ��������������������Ӻ�̼������ӣ�Ӧ����������Ȼ�����Һ��̼�������������ɲ�����ˮ�ı��Σ�ͬʱ�����Ȼ��أ��ù��˵ķ������з��룬��Ӧ�����ӷ���ʽΪBa2++SO42-=BaSO4 ����Ba2++CO32-=BaCO3�� ��
��2��������Һ�е� �Ƿ���SO42-�ķ�����ȡ������Һ���Թ��У������м���������ᣬ�ټ���BaCl2��Һ�����а�ɫ�������ɣ�����SO42-����֮���ޡ�
��3�����˺����Ȼ������Ȼ�����ҺA��Ȼ����������̼�����Һ��ȥ��Һ�е��Ȼ��������ˣ��õ��Ȼ��غ�̼��ػ��ҺD��
��4��Ҫ���������̼������ӣ�Ҫ�μ����������ᣬ̼������Ӻ����ᷴӦ���ɶ�����̼��ˮ�����ӷ���ʽΪ��CO32-+2H+=CO2��+H2O��
��5����25mL�Ȼ�����Һ���Ȼ��ص����ʵ���Ϊnmol��
KCl+AgNO3=AgCl+KNO3
1mol 1mol
nmol 0.1000molL-1��0.02350L��n=0.002350mol
100mL��Һ�к����Ȼ��ص����ʵ���=0.002350mol��4=0.0094mol��100mL��Һ�к����Ȼ��ص�����=0.0094mol��74.5g/mol=0.7003g����������=(0.7003g/0.745g)��100%=94%���ʴ�Ϊ��94%��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҹ۲�������������ץȡ��һ����̼���Ӻ���ԭ��������ɶ�����̼���ӵĹ��̡����й���̼���������˵����ȷ����
A. CO��CO2��Ϊ���������� B. CO��ú������Ҫ�ɷ�֮һ
C. CO2��������� D. ����CO2���ŷſɵ���������γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]̼���仯����㷺��������Ȼ���У��ش��������⣺
��1������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ����� �����������ڻ�̬ԭ���У�������� �������෴�ĵ��ӡ�
��2��̼���γɻ�����ʱ��������Թ��ۼ�Ϊ����ԭ���� ��
��3��CS2�����У����ۼ��������� ��Cԭ�ӵ��ӻ���������� ��д��������CS2������ͬ�ռ乹�ͺͼ�����ʽ�ķ��ӻ����� ��
��4��CO�������Fe�γ�Fe(CO)5���û�������۵�Ϊ253K���е�Ϊ376K����������� ���塣
̼�ж���ͬ�������壬����ʯīϩ����ʯ�ľ���ṹ��ͼ��ʾ��

����ʯīϩ�����У�ÿ��Cԭ������ ����Ԫ����ÿ����Ԫ��ռ�� ��Cԭ�ӡ�
���ڽ��ʯ�����У�Cԭ�������ӵ���С��ҲΪ��Ԫ����ÿ��Cԭ������ ����Ԫ������Ԫ��������� ��Cԭ����ͬһƽ�档
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��ͭ��ϡ���ᷴӦ�IJ��PӰ�췴Ӧ���ʵ���Ҫ���أ���������ʵ�顣
ʵ��һ ̽��ͭ��ϡ���ᷴӦ�IJ���ʵ��װ����ͼ��ʾ���������Ѽ�顣

��֪��FeSO4��NO===[Fe(NO)]SO4���÷�Ӧ�ϻ�����������һ����[Fe(NO)]2��ʱͻ������
��ɫ��
(1)ʵ�鿪ʼʱ�Ƚ�Y���Թ���ʢ��̼��Ƶ�֧����б����������ϡ���ᣬ��ʵ�������Ŀ����___________________________________________________________��
(2)ͭƬ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ____________________________________��
(3)��ʵ��A���ɵ������У�����NO2����B��ʵ������Ϊ__________________��
��ֻ��NO���ɣ���B��ʵ��������_________________��
ʵ��� ̽����ѧ��Ӧ����Է�Ӧ���ʵ�Ӱ��
�������ʵ�飬������ͼװ�òⶨ��Һͻ��������ɫ��ʱ�䡣
��� | �¶� | ͭƬ/(g) | ����/mL | ����ͭ/g |
1 | 25 �� | �� | �� | �� |
2 | 25 �� | 5 | 20 | 0.5 |
3 | 25 �� | 5 | 20 | 1.0 |
(4)�뽫�ϱ���ʵ��1��ʵ��������д������
��________����________����________��
(5)ͨ��ʵ�鷢��ʵ��1��2��3�ķ�Ӧ���ʲ������Ա仯��Ϊ�ﵽʵ��Ŀ�Ļ���Ҫ�������е�ʵ����_______________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������·�����Ӧ��2X(g)![]() Y(g)+3Z(g) ��H=akJ��mol-1(a>0)������˵����ȷ����
Y(g)+3Z(g) ��H=akJ��mol-1(a>0)������˵����ȷ����
A. ����X��Ũ�ȣ�����Ӧ���������淴Ӧ���ʼ�С
B. �ﵽ��ѧƽ��״̬ʱ�������淴Ӧ�����ʶ�Ϊ0
C. ��0.2molX���뷴Ӧ���У���ַ�Ӧ�����ɵ�Z�����ʵ�������Ϊ0.09mol
D. �ﵽ��ѧƽ��״̬ʱ��������a kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨ�Ҷ��ᣩ��������Ȼ���ֲ���У���K1=5.4��10��2��K2=5.4��10��5����������κͼ���������ˮ���������������ˮ�����ᾧ�壨H2C2O42H2O����ɫ���۵�Ϊ101����������ˮ��������ˮ��������170�����Ϸֽ⣮�ش��������⣺

��1������ͬѧ������ͼ��ʾ��װ�ã�ͨ��ʵ�������ᾧ��ķֽ���װ��C�пɹ۲쵽�������� ���ɴ˿�֪���ᾧ��ֽ�IJ������� ��װ��B����Ҫ������ ��
��2������ͬѧ��Ϊ���ᾧ��ֽ�IJ����к���CO��Ϊ������֤��ѡ�ü���ʵ���е�װ��A��B����ͼ��ʾ�IJ���װ�ã������ظ�ѡ�ã�����ʵ�飮
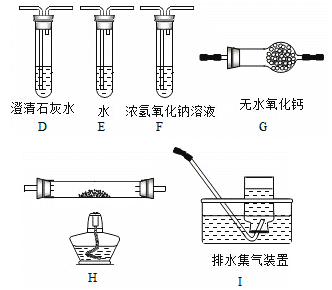
������ͬѧ��ʵ��װ���У��������ӵĺ���˳��ΪA��B�� װ��H��Ӧ����ʢ�е������� ��
����֤�����ᾧ��ֽ��������CO��������
��3�������ʵ��֤����
����������Ա�̼���ǿ
������Ϊ��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����98%��Ũ����(���ܶ�Ϊ1.84 g/cm3)����100 mL 1.0 mol��L��1ϡ����,
ʵ�鲽�����£��� ��������Ũ�������� �� ��ȡһ�������Ũ���� �� �ܽ� �ܼ�©�� ת�ơ�ϴ�� �� ���ݡ�ҡ��
��ʵ�������У�A��100 mL��Ͳ B��������ƽ C�������� D��50 mL����ƿ E.10 mL��Ͳ F.��ͷ�ι� G.50 mL�ձ� H.100 mL����ƿ
�ش��������⣺
��1������ȡŨ��������Ϊ__________mL��
��2��ʵ��ʱѡ�õ�������(�����) _______________,
��3�����ƹ����У����������ʹ���ƽ��ƫ�ߵ���(�����) _______________
�ٶ���ʱ���ӿ̶��߹۲�Һ�� ������ƿʹ��ʱδ����
�۶��ݺ���ҡ�ȡ����ã�����Һ����ڿ̶��ߣ�δ�ټ�����ˮ�����̶���
��.���õ�Ũ���᳤ʱ��������ܷⲻ�õ������Т�����Ͳ��ȡŨ����ʱ���Ӷ���
��4�������Լ�ƿ�е���Һ����SO42- �IJ�����____________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �����Ҫ�ϳ�
�����Ҫ�ϳ� ![]() �����õ�ԭʼԭ�Ͽ����ǣ� ��
�����õ�ԭʼԭ�Ͽ����ǣ� ��
A. 2 -��-l��3 -����ϩ��1 -��Ȳ B. l��3 �C���ϩ��2 -��Ȳ
C. 2��3 -����-1��3 -���ϩ����Ȳ D. 2��3 -����-l��3 -����ϩ�ͱ�Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������������Na2CO3��Na2SO4��CuSO4��CaCl2��NaCl�Ȼ�϶��ɣ�Ϊ�������ǣ���������ʵ�飺
����������������ˮ�У���������ɫ����Һ��
��������Һ�еμ����ᱵ��Һ���а�ɫ����������
�����ˣ�������������ϡ�����У����ֳ���ȫ���ܽ⡣
��������ʵ����ʵ���ش��������⣺
(1)ԭ����������һ�����е�������________��һ�������е�������________�����ܺ��е�������________(���Ͽո����д��ѧʽ)���Կ��ܺ��е����ʣ��ɲ�������Һ�еμ�___________________��Һ�ķ��������顣
(2)д���������е����ӷ���ʽ__________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com