
【题目】某溶液可能含有Cl-、SO![]() 、CO
、CO![]() 、NH
、NH![]() 、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子B.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
C.SO![]() 、NH
、NH![]() 一定存在,Cl-可能不存在D.CO
一定存在,Cl-可能不存在D.CO![]() 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
【答案】B
【解析】
由于加入过量NaOH溶液,加热得到0.02mol气体,说明一定有NH4+,且物质的量为0.02mol;同时产生红褐色沉淀,说明一定有Fe3+,1.6g固体为氧化铁,物质的量为0.01mol,故有0.02molFe3+,一定没有CO32-;4.66g不溶于盐酸的沉淀为硫酸钡,一定有SO42-,物质的量为0.02mol;根据电荷守恒,一定有Cl-,至少 0.02mol×3+0.02-0.02mol×2=0.04mol,物质的量浓度至少0.04mol÷0.1L=0.4mol/L。
A、至少存在Cl-、SO42-、NH4+、Fe3+四种离子,故A错误;
B、根据电荷守恒,至少存在0.4mol/L Cl-,故B正确;
C、一定存在氯离子,故C错误;
D、Al3+无法判断是否存在,故D错误;
故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。

(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达不正确的是( )
①丙烷的球棍模型 ②丙烯的结构简式为CH3CHCH2
②丙烯的结构简式为CH3CHCH2
③某有机物的名称是2,3-二甲基戊烷 ④![]() 与C8H6互为同分异构体
与C8H6互为同分异构体
A. ①②B. ②③C. ②④D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室制取乙烯的发生装置和验证乙烯性质的实验装置,反应原理为 CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
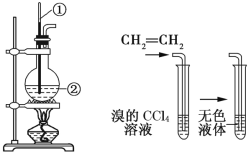
图1 图2
回答下列问题:
(1)图1中仪器①、②的名称分别为_______、_______。
(2)收集乙烯气体最好的方法是__________________。
(3)向溴的CCl4溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于_______(填反应类型),发生反应的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KNO3和Cu(NO3)2的混合溶液200mL,其中c(NO3-)=2mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况),假设电解后溶液体积不变,下列说法正确的是( )
A.原混合溶液中c(K+)=0.5mol·L-1
B.电解得到的Cu的物质的量为0.2mol
C.上述电解过程中共转移0.4mol电子
D.电解后溶液中c(H+)=2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
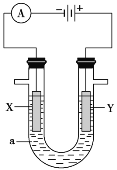
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为__________________,在X极附近观察到的现象是__________________。
②Y电极上的电极反应式为_____________,检验该电极反应产物的方法是______________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:①Y电极的材料是_______________,主要的电极反应式为_____________________。
②溶液中的c(Cu2+)与电解前相比________(填“变大”、“变小”或“不变”)。
(3)如利用该装置实现铁上镀锌,电极X上发生的反应为_______________________,电解池盛放的电镀液可以是__________________________(只要求填一种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某恒容密闭容器中含有![]() 、
、![]() 两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如下所示。
两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如下所示。

(1)表示 NO2浓度变化的曲线是________________,写出相应的化学方程式:________________________
(2)从反应开始至达到平衡的过程中,用![]() 表示的反应速率
表示的反应速率![]() =__________________________,a、b两点对应状态中,曲线X代表的物质的反应速率相对大小为v(a)_____v(b)。
=__________________________,a、b两点对应状态中,曲线X代表的物质的反应速率相对大小为v(a)_____v(b)。
(3)下列叙述说明该反应达到化学平衡的是_______________________
A、单位时间生成n mol NO2同时生成n mol N2O4
B、容器内气体颜色不变
C、混合气体的密度不变
D、混合气体的平均相对分子质量不变
E、混合气体的物质的量不变
F、容器内气体压强不变
G、混合气体中NO2的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火法炼铜是目前世界上最主要的冶炼铜的方法,其产量可占到铜总产量的85%以上,火法炼铜相关的方程式有
Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H1=-271.4kJ/mol 反应①
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) △H2=+123.2kJ/mol 反应②
(1)Cu2S(s)在空气中煅烧生成Cu2O(s)和SO2(g)的热化学方程式是___。
(2)火法炼铜所得吹炼烟气中SO2含量较高,该烟气在工业上可直接用于生产硫酸,从绿色化学角度考虑其优点有____(任写一条)。
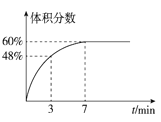
(3)在2L的恒温密闭容器中通入5mol氧气并加入足量Cu2S发生反应①(不考虑其它反应),容器中的起始压强为akPa,反应过程中某气体的体积分数随时间变化如图所示,反应前3min平均反应速率v(SO2)=___mol/(L·min),该温度下反应的平衡常数KP=___(KP为以分压表示的平衡常数)。若保持温度不变向平衡体系中再通入1mol氧气,达到新平衡后氧气的体积分数___(填“大于”“小于”或“等于”)原平衡时氧气的体积分数。
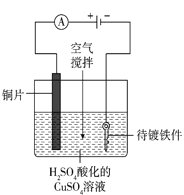
(4)工业上电镀铜的装置如图所示,阳极产物除Cu2+外还有部分Cu+,部分Cu+经过一系列变化会以Cu2O的形式沉积在镀件表面,导致镀层不够致密、光亮。电镀过程中用空气搅拌而不是氮气搅拌的原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com