
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
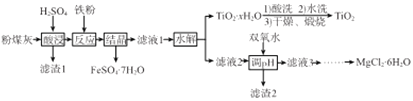
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]=1.0×10-11
请回答下列问题:
(1)“酸浸”时TiO2发生反应的离子方程式为_______________。
(2)“反应”时加入铁粉的作用为_______________。
(3)“结晶”需控制在70℃左右,温度过高会导致的后果为_____________。
(4)“水解”反应的离子方程式为______________。所得TiO2xH2O 沉淀进行酸洗的目的为____________。
(5)为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”最小为________。
(6)实验室用MgCl2溶液制备MgCl26H2O,需进行的操作为_____、降温结晶、过滤、洗涤、干燥。
(7)FeSO47H2O样品纯度的测定:取a g样品溶于水配成bmL.溶液;用酸化的cmol/LKMnO4标准溶液滴定,达到滴定终点时消耗标准液的体积为dmL,样品中FeSO47H2O的质量分数为____ (用代数式表示)。
【答案】 TiO2+2H+=TiO2++H2O 将Fe3+还原为Fe2+ 导致TiO2+提前水解使FeSO4·7H2O混有TiO2·xH2O,并使TiO2·xH2O产率降低 TiO2++(x+1)H2O=TiO2·xH2O+2H+ 洗去粘附的FeSO4,防止FeSO4水解 4.3 在不断通入HC1的条件下蒸发浓缩 ![]()
【解析】粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等,经硫酸酸浸后过滤,所得滤液中含有Al2(SO4)3、FeSO4、Fe2(SO4)3、MgSO4、TiOSO4,SiO2与硫酸不反应,滤渣1为SiO2,向滤液中加入铁粉,Fe与Fe2(SO4)3反应生成FeSO4,结晶得FeSO4·7H2O,所得滤液1中含有Al2(SO4)3、MgSO4、TiOSO4和少量FeSO4,TiOSO4水解生成TiO2·xH2O,经酸洗、水洗、干燥和灼烧后得TiO2,滤液2中含有Al2(SO4)3、MgSO4和少量FeSO4,加入双氧水将Fe2+氧化成Fe3+,调节溶液pH使Al3+、Fe3+生成Al(OH)3、Fe(OH)3,过滤得滤渣2中含有Al(OH)3、Fe(OH)3沉淀,滤液3中含有MgCl2,经蒸发浓缩、冷却结晶、过滤得MgCl2·6H2O。
(1). “酸浸”时TiO2与硫酸发生反应生成TiOSO4,离子方程式为TiO2+2H+=TiO2++H2O,故答案为:TiO2+2H+=TiO2++H2O;
(2). “反应”时加入铁粉,Fe与Fe3+反应生成Fe2+,故答案为:将Fe3+还原为Fe2+;
(3). TiO2+在较高温度下会水解转化为TiO2·xH2O,则“结晶”时温度应控制在70℃左右,若温度过高,会造成TiO2+提前水解,使FeSO4·7H2O中混有TiO2·xH2O,同时还会降低TiO2·xH2O的产率,故答案为:导致TiO2+提前水解使FeSO4·7H2O混有TiO2·xH2O,并使TiO2·xH2O产率降低;
(4). TiO2+发生“水解”反应生成TiO2·xH2O,离子方程式为TiO2++(x+1)H2O=TiO2·xH2O+2H+,所得TiO2xH2O沉淀进行酸洗,可以除去沉淀表面的FeSO4等杂质,同时在酸性条件下洗涤可防止FeSO4水解,故答案为:TiO2++(x+1)H2O=TiO2·xH2O+2H+;洗去粘附的FeSO4,防止FeSO4水解;
(5). 调节pH的目的是使溶液中的Al3+、Fe3+生成Al(OH)3、Fe(OH)3沉淀而除去,因Al(OH)3和Fe(OH)3的阴、阳离子个数比相同,Ksp[Al(OH)3]>Ksp[Fe(OH)3],则Al3+完全沉淀时,Fe3+也已经完全沉淀,所以使Al3+沉淀完全对应溶液的pH即为最小的pH,由题中数据可知,Al3+完全沉淀时,c3(OH-)=  =
=![]() =10-29,由c(H+)=
=10-29,由c(H+)= 和pH=-lgc(H+)解得pH=4.3,故答案为:4.3;
和pH=-lgc(H+)解得pH=4.3,故答案为:4.3;
(6). 用MgCl2溶液制备MgCl26H2O晶体,需要经过蒸发浓缩、降温结晶、过滤、洗涤、干燥等操作,因加热蒸发时会促进MgCl2的水解,为抑制MgCl2的水解,应在不断通入HC1的条件下进行蒸发浓缩,故答案为:在不断通入HC1的条件下蒸发浓缩;
(7). 酸性高锰酸钾溶液氧化FeSO4的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,由方程式可知,n(FeSO47H2O)=5n(KMnO4)=5×d×10-3L×cmol/L=5cd×10-3mol,m(FeSO47H2O)= 5cd×10-3mol×278g/mol=1.39cd g,则样品中FeSO47H2O的质量分数为: ![]() ×100%,故答案为:
×100%,故答案为: ![]() ×100%。
×100%。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】金属钒(V)及其化合物有着广泛的用途。请回答以下问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是_____,请写出溶液中VO3-转化为V2O74-的离子方程式:____________。
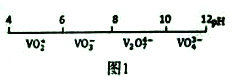
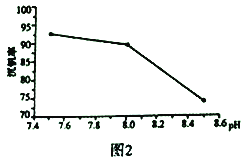
(2)“弱碱性按盐沉钒法”原理是在含有钒元素的溶液中加入铵盐后形成NH4VO3沉淀,图2是在工业生产中不同pH环境下沉钒率的测定值。实际工业生产中常选择pH=7.5为沉钒的最佳条件,当pH超过8.0时沉钒率降低,其原因是溶液中VO3-转化为V2O74-、_______。(请另写出一点原因)
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)![]() 2SO3(g) △H=p的催化剂,其催化原理如图3所示。
2SO3(g) △H=p的催化剂,其催化原理如图3所示。
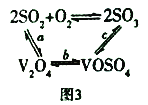
①过程a和过程b的化学方程式为:V2O5(s)+SO2(g)=V2O4(s)+SO3(g)△H=q;
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(g)△H=r
请写出过程c的热化学方程式:_________________。
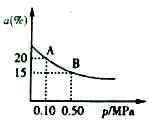
②t2℃下,反应:2SO3(g)![]() 2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。t℃下,将2molSO3置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。B点的化学平衡常数的值是__________。
2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。t℃下,将2molSO3置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。B点的化学平衡常数的值是__________。
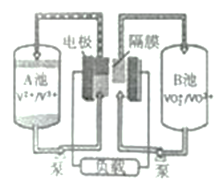
(4)全钒夜流电池是一种可充电电池,装置如图所示。若在放电过程中有H+从A池移向B池,则:
①放电过程中,起负极作用的是_______池(填“A”或“B”)。
②充电过程中,阳极方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、S02等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式____________________________________,该热化学方程式的平衡常数K=_________(用K1、K2、K3表示)。
(2)在体积可变的恒压(p总)密闭容器中充入1molCO2 与足量的碳,让其发生反应: C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
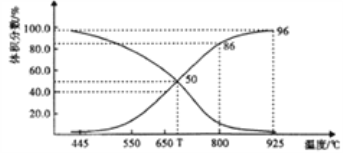
①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“="),平衡______移动(填“正向”“逆向”或“不”。下同);若充入等体积的CO2 和CO,平衡________移动。
②CO体积分数为40%时,CO2 的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡Kp常数的表达式为__________;925℃时,Kp=______(用含p总的代数式表示)。
(3)直接排放含SO2 的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是______________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是
)的说法正确的是
A. a、b、c的分子式均为C8H8
B. a、b、c均能与溴水发生反应
C. a、b、c中只有a的所有原子会处于同一平面
D. a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 浓硫酸溶于水是放热反应
C. 反应物和生成物所具有的总能量决定了放热还是吸热
D. 断开化学键放热,形成化学键吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子①F- ②Na+ ③HF ④NH3⑤CH4其中与氖原子含有相同电子数的是( )
A. ①②③ B. ②③④ C. ①②⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
化学键 | H—O | O=O | N≡N | N—H |
键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是__________________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
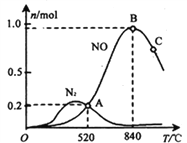
①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的SO2,
①若氨水与SO2恰好完全反应生成正盐,则此时溶液呈_____性(填“酸”或“碱”)常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10ˉ5mol·Lˉ1;H2SO3 :Ka1=1.3×10ˉ2mol·Lˉ1,Ka2=6.3×10ˉ8mol·Lˉ1
②上述溶液中通入______气体可使溶液呈中性,(填“SO2”或NH3”)此时溶液离子浓度由大到小的顺序_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.用托盘天平称取1.06gNa2CO3固体
B.用10mL量筒量取8.58mL蒸馏水
C.用稀盐酸洗净做焰色反应的铁丝
D.为了加快过滤的速率,用玻璃搅拌过滤器中的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.5 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH 溶液在右图所示的装置(代替量热计)中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
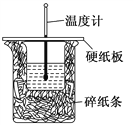
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________。
(2)烧杯间填满碎纸条的作用是___________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大”“偏小”“无影响”)。
(4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50 mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。
(5)实验中改用 50mL 0.50 mol· L-1的醋酸跟 50 mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”)。简述理由______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com