
【题目】对于工业合成氨反应:N2+3H2![]() 2NH3,下列说法错误的是( )
2NH3,下列说法错误的是( )
A.使用合适的催化剂可以加大反应速率B.升高温度可以增大反应速率
C.增大N2浓度可以使H2完全反应D.增大N2浓度可以增大反应速率
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:
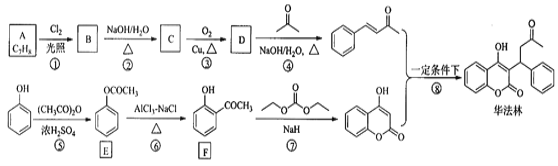
回答下列问题:
(1)A的名称为________,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为___________
(4)⑤的反应类型为_________,⑧的反应类型为________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有___________种。
a.能与FeCl3溶液发生显色反应 b.含有-CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2X表示)在水中的电离方程式是:H2X=H++HX- HX-![]() H++X2-,常温下,向10 mL 0.1000 mol/L的H2X溶液中逐滴加入0.1000 mol/L的NaOH溶液,pH随NaOH溶液体积的变化如图所示。下列叙述中正确的是
H++X2-,常温下,向10 mL 0.1000 mol/L的H2X溶液中逐滴加入0.1000 mol/L的NaOH溶液,pH随NaOH溶液体积的变化如图所示。下列叙述中正确的是
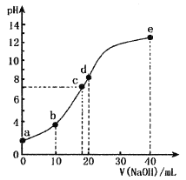
A.a点pH>1
B.b点溶液中:c(Na+)>c(HX-)>c(X2-)>c(H2X)>c(H+)>c(OH-)
C.d点溶液中:c(Na+)=2c(X2-)+2c(HX-)
D.水的电离程度:c>a>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生成水的能量关系如图所示:下列说法不正确的是
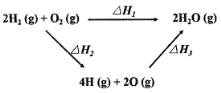
A.△H2>0
B.若2H2(g)+O2(g)=2H2O(l) △H4,则△H4<△H1
C.一定条件下,气态原子生成1 mol H-O放出a kJ热量,则该条件下△H3=-4akJ/mol
D.△H1+△H2+△H3=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的许多化合物在生产、生活中有着广泛的应用,如FeCl3是重要的金属蚀刻剂、水处理剂;影视作品拍摄中常用Fe(SCN)3溶液模拟血液;FeS可用于消除水中重金属污染等。
(1)已知:①3Cl2(g)+2Fe(s)=2FeCl3(s) ΔH1=akJ·mol-1
②2FeCl2(s)+Cl2(g)=2FeCl3(s) ΔH2=bkJ·mol-1
则2FeCl3(s)+Fe(s)=3FeCl2(s) ΔH3=____。
(2)将c(FeCl3)=0.2mol·L-1的溶液与c(KSCN)=0.5mol·L-1的溶液按等体积混合于某密闭容器发生反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,测得常温下溶液中c(Fe3+)的浓度随着时间的变化如图1所示;测得不同温度下t1时刻时溶液中c[Fe(SCN)3]如图2所示。
Fe(SCN)3+3KCl,测得常温下溶液中c(Fe3+)的浓度随着时间的变化如图1所示;测得不同温度下t1时刻时溶液中c[Fe(SCN)3]如图2所示。
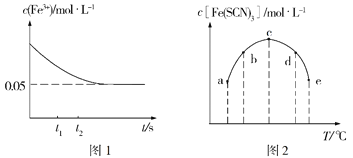
①研究表明,上述反应达到平衡后,向体系中加入适量KCl固体后,溶液颜色无变化,其原因是___,根据图1分析,在t1、t2时刻,生成Fe3+的速率较大的是____时刻。
②常温下Fe3++3SCN-![]() Fe(SCN)3的平衡常数的值约为___,其它条件不变时,若向容器中加适量蒸馏水,则新平衡建立过程中v(正)___v(逆)(填“>”“<”或“=”)。
Fe(SCN)3的平衡常数的值约为___,其它条件不变时,若向容器中加适量蒸馏水,则新平衡建立过程中v(正)___v(逆)(填“>”“<”或“=”)。
③根据图2判断,该反应的ΔH___0(填“>”或“<”),图中五个点对应的状态中,一定处于非平衡态的是___(填对应字母)。
(3)利用FeS可除去废水中的重金属离子,如用FeS将Pb2+转化为PbS可消除Pb2+造成的污染,当转化达到平衡状态时,废水中c(Fe2+)=___c(Pb2+)[填具体数据,已知Ksp(PbS)=8×10-28,Ksp(FeS)=6×10-18]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硬脂酸甘油酯在碱性条件下水解的装置如图所示。
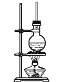
进行皂化反应实验的操作步骤如下:
(1)在圆底烧瓶中加入7~8g硬脂酸甘油酯,然后加入2~3gNaOH、5mL水和10mL酒精,其中加入酒精的作用是___。
(2)加热反应混合物约10min,皂化反应基本完成,所得的混合物为___(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入食盐细粒,静置一段时间,溶液分为上下两层,高级脂肪酸钠盐在___层,这个过程称为___。
(4)装置中长玻璃导管的作用为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体![]() 的一种方案如下:
的一种方案如下:
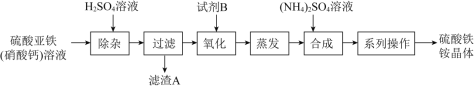
下列说法不正确的是![]()
![]()
A.滤渣A的主要成分是![]()
B.“系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等
C.相同条件下,![]() 溶解度
溶解度![]() e2(SO4)3小
e2(SO4)3小
D.“氧化”反应中试剂B可选NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气转变为甲醇过程中,涉及如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
A.在0~5min内,v(H2)=0.1 mol·L-1·min-1
B.当反应达到平衡时,CO和H2的物质的量之比为1:2
C.其他条件不变时,若将该体系换成恒温(起始温度为T)恒容密闭容器,则CO的平衡转化率将增大
D.5min后,将甲醇液化分离出,此时平衡正向移动,正反应速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com