
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是 (填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
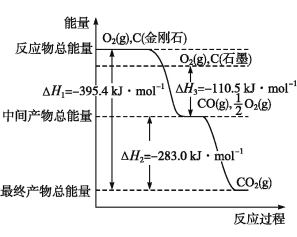
①在通常状况下,金刚石和石墨中 (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为 。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为 。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol1、497 kJ·mol1。
N2(g)+O2(g)![]() 2NO(g) ΔH=180.0 kJ·mol1。
2NO(g) ΔH=180.0 kJ·mol1。
NO分子中化学键的键能为 kJ·mol1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式: 。
【答案】(1)acd(1分)
(2)①石墨(1分) 393.5 kJ·mol1(2分) ②252.0 kJ(3分)
(3)631.5(3分)
(4)2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=746.0 kJ·mol1(2分)
N2(g)+2CO2(g) ΔH=746.0 kJ·mol1(2分)
【解析】(2)①石墨的能量更低,更稳定。石墨的燃烧热指101 kPa下1 mol石墨完全燃烧生成CO2时放出的热量。②12 g石墨和24 g氧气反应,即1 mol C和0.75 mol O2反应,则生成0.5 mol CO和0.5 mol CO2,放出热量0.5 mol×110.5 kJ·mol1+0.5 mol×393.5 kJ·mol1=252.0 kJ。(3)ΔH=E(N2键能)+E(O2键能)2E(NO键能),2E(NO键能)=946 kJ·mol1+497 kJ·mol1180.0 kJ·mol1,E(NO键能)= 631.5 kJ·mol1。(4)已知:2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1,N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ·mol1,N2(g)+O2(g)![]() 2NO(g) ΔH=180.0 kJ·mol1,目标反应2NO(g)+2CO(g)
2NO(g) ΔH=180.0 kJ·mol1,目标反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)可由前者减后者获得,则ΔH= 746.0 kJ·mol1。
N2(g)+2CO2(g)可由前者减后者获得,则ΔH= 746.0 kJ·mol1。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“一”相连的两种物质能发生反应)。下列判断一定正确的是( )

A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期ⅠA族
C. 4种原子中,Y原子半径最大 D. W的最高化合价为+7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Mg2+、Ba2+、Cl-、HCO3-中的一种或几种离子。为确定其成分,进行以下实验:
实验1:取l0mL无色溶液,滴加适量稀盐酸无明显现象。
实验2:另取l0mL无色溶液,加入足量的Na2SO4溶液,有白色沉淀生成。
实验3:将实验l后的溶液于锥形瓶中,向锥形瓶中逐滴加入NaOH溶液,滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图所示。

回答下列问题:
(1)原溶液中不存在的离子有________,存在的离子有___________________。
(2)实验3中,图像中OA段反应的离子方程式为___________________。
(3)根据图像计算原溶液中Mg2+的物质的量浓度______________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)![]() 2H2O(l) △H=571.6 kJ/mol,则氢气的燃烧热为285.8 kJ/mol
2H2O(l) △H=571.6 kJ/mol,则氢气的燃烧热为285.8 kJ/mol
B.已知C(石墨,s)![]() C(金刚石,s) △H>0 ,则金刚石比石墨稳定
C(金刚石,s) △H>0 ,则金刚石比石墨稳定
C.含20.0 gNaOH稀溶液与稀盐酸完全中和,放出28.7 kJ热量,则稀醋酸和稀NaOH溶液反应热化学方程式为NaOH(aq) + CH3COOH(aq)![]() CH3COONa(aq) + H2O(1) △H=57.4 kJ/mol
CH3COONa(aq) + H2O(1) △H=57.4 kJ/mol
D.已知2C(s)+2O2(g)![]() 2CO2(g) △H1;2C(s)+O2(g)
2CO2(g) △H1;2C(s)+O2(g)![]() 2CO(g) △H2,则△H1>△H2
2CO(g) △H2,则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大的五种短周期主族元素,A的简单离子核外没有电子,B、C、D位于同一周期,D、E位于同一主族,B元素在自然界中形成的化合物种类最多,D元素的氢化物是最常用的溶剂。
请回答:
(1)BD2的电子式___________________________;
(2)C、D、F离子半径由大到小的顺序为_________________(用离子符号表示)
(3)用一个化学方程式表示证明非金属性F>E:_____________________________
(4)X、Y两种化合物均是强电解质,且均由A、C、D三种元素组成的,X能抑制水的电离,Y能促进水的电离,在一定条件下,X、Y可以相互转化。写出X转化成Y的化学方程式_______________________。
(5)用下面的装置和药品探究A2ED3与AFD的酸性的强弱:

装置连接顺序为_______________(用字母表示),其中装置C的作用是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。

(1)mg铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
① 常温下碳与浓硫酸不反应;②________________________。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程____________________________。
(3)B中的现象是:_______________________;C的作用是:___________________。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg.则铁碳合金中铁的质量分数为________________(写表达式)。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某小组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。

已知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)滤液A的主要成分________(填写化学式),滤液B中所含金属阳离子为_________。
(2)反应①的离子方程武是_________________________________。
(3)反应①之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是__________________。
(4)反应②的化学反应方程式是____________________________。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
![]()
若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数________。(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A. 反应热指的是反应过程中放出的热量 B. 伴随着能量变化的过程不一定是化学反应
C. 中和反应都是放热反应 D. 单液原电池中化学能转化成电能和热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定条件下一定能大量共存的是( )
A. 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
B. 常温下,![]() 的溶液:Na+、CO32-、NO3-、A1O2-
的溶液:Na+、CO32-、NO3-、A1O2-
C. 无色溶液中:K+、A1O2-、HCO3-、Cr2O72-
D. pH=1的溶液中: Na+、A13+、NO3-、S2O32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com