
【题目】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为_______________ 。
(2)生产农药的原料 PSCl3 中 P、S、Cl 的第一电离能由大到小的顺序为____电负性由大到小的顺序为__________________________。
(3)H2SO4为粘稠状 难挥发性的酸 ,而 HNO3 是易挥发的酸,其原因是__________
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为________,所含共价 键的类型为_____________,N2O与CO2互为等电子体 ,且N2O 分子中O只与一个N相连,则N2O的电子式为_______________ 。
(5)AlP 因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。

①磷化铝的晶体类型为 _____________________ 。
②A、B 点的原子坐标如图所示,则C点的原子坐标为 __________________ 。
③磷化铝的晶胞参数a = 546.35 pm(l pm=10—12 m), 其密度为________g/cm3( 列出计算式即可,用NA表示阿伏加德罗常数的数值)。
【答案】4s24p3 Cl>P>S Cl>S>P H2SO4分子之间易形成氢键,分子间作用力增强,故难挥发;而HNO3易形成分子内氢键,造成分子间作用力减弱,易挥发 sp σ键和π键 ![]() 原子晶体 (1/4,1/4,3/4)
原子晶体 (1/4,1/4,3/4) ![]()
【解析】
(1)As是33号元素,处于周期表中第四周期第VA族,其4s、4p能级上的电子为其价电子;
(2)同周期随原子序数增大元素第一电离能呈增大趋势,As元素原子4p能级为半充满稳定状态,第一电离能高于同周期相邻元素的;同周期主族元素自左而右电负性增大;
(3)根据分子间氢键和分子内氢键推理得出;
(4)COS(羰基硫)中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化类型,共价双键中含有1个σ键、1个π键;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N、N原子之间存在共价双键;
(5)①AlP熔点高,原子之间形成空间立体网状结构;
②白色球C周围的黑色球形成正四面体结构,白色球处于正四面体体心,顶点黑色球与C的连线处于晶胞体对角线上,由几何知识计算C的坐标;
③利用公式晶胞密度![]() 计算;
计算;
(1)As是33号元素,处于周期表中第四周期第VA族,其4s、4p能级上的电子为其价电子,其价电子排布式为4s24p3,
故答案为:4s24p3;
(2)同周期随原子序数增大元素第一电离能呈增大趋势,As元素原子4p能级为半充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能为:Cl>P>S.同周期主族元素自左而右电负性增大,故电负性:Cl>S>P,
故答案为:Cl>P>S;Cl>S>P;
(3) H2SO4分子之间易形成氢键,分子间作用力增强,故难挥发;而HNO3易形成分子内氢键,造成分子间作用力减弱,易挥发,
故答案为:H2SO4分子之间易形成氢键,分子间作用力增强,故难挥发;而HNO3易形成分子内氢键,造成分子间作用力减弱,易挥发;
(4)COS(羰基硫)结构式为O=C=S,该分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化类型为sp,共价双键中含有1个σ键、1个π键,所以该分子中含有σ键和π键;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N、N原子之间存在共价双键,其电子式为![]() ,
,
故答案为:sp;σ键和π键;![]() ;
;
(5)①AlP熔点高,原子之间形成空间立体网状结构,属于原子晶体,
故答案为:原子晶体;
②白色球C周围的黑色球形成正四面体结构,白色球处于正四面体体心,顶点黑色球与C的连线处于晶胞体对角线上,由几何知识可知二者连线等于晶胞体对角线长度的![]() ,C到左侧平面距离等于晶胞棱长的
,C到左侧平面距离等于晶胞棱长的![]() ,即参数x的值,C到前平面距离等于晶胞棱长的
,即参数x的值,C到前平面距离等于晶胞棱长的![]() ,即参数y的值,C到下底面距离等于晶胞棱长的
,即参数y的值,C到下底面距离等于晶胞棱长的![]() ,即参数z的值,故C点的原子坐标为(
,即参数z的值,故C点的原子坐标为(![]() ,
,![]() ,
,![]() ),
),
故答案为:(1,14,34);
③该晶胞中P原子个数![]() 、Al原子个数为4,晶胞体积a3,晶胞密度
、Al原子个数为4,晶胞体积a3,晶胞密度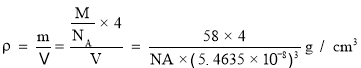 ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
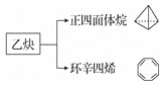
下列说法正确的是( )
A.正四面体烷的分子式为C4H8B.正四面体烷二氯取代产物有1种
C.环辛四烯核磁共振氢谱有2组峰D.环辛四烯与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,有科研工作者提出可用如图所示装置进行水产养殖用水的净化处理。该装置工作时,下列说法错误的是
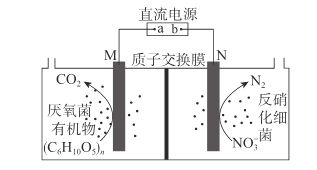
A.导线中电子由M电极流向a极
B.N极的电极反应式为2NO3-+10e-+12H+=N2↑+6H2O
C.当电路中通过24 mol电子的电量时,理论上有1 mol (C6H10O5)n参加反应
D.当生成1 mol N2时,理论上有10 mol H+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,用a来说明HA是强酸还是弱酸___。
(2)不考虑其它组的实验结果,单从乙组情况分析,c是否一定等于0.2___(选填“是”或“否”).混合液中离子浓度c(A-)与c(Na+)的大小关系是___。
(3)丙组实验结果分析,HA是___酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是___。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=___molL-1。写出该混合溶液中下列算式的精确结果(不能做近似计算)
c(Na+)-c(A-)=__molL-1
c(OH-)-c(HA)=__molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上作了如下记录,其中合理的是 ( )
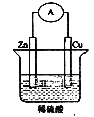
实验记录:①导线中电流方向:锌→铜②铜极上有气泡产生③锌片变薄
实验结论:④Zn为正极,Cu为负极⑤铜比锌活泼⑥H+向铜片移动
A.①②③B.④⑤⑥C.③④⑤D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是( )
A.检验 Na2O2试样是否变质为 Na2CO3:向试样中加入盐酸,产生无色无味的气体
B.检验某卤代烃是否是氯代烃: 试样 ![]() 冷却
冷却![]()
![]() 出现白色沉淀
出现白色沉淀
C.除去溴乙烷中混有的溴:混合液![]()
![]() 溶液分层
溶液分层![]() 得下层
得下层
D.鉴定盐 A 的成分是 FeBr2:
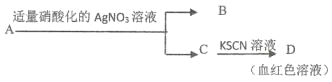
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知对于电离常数为Ka的某一元弱酸滴定过程中,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是( )
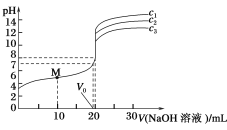
A.由图可知,c1>c2>c3
B.M点溶液中存在:c(H+)+c(HA)=c(OH-)+c(A-)
C.恰好中和时,溶液中离子浓度的大小关系:c(Na+)>c(A-)>c(OH-)>c(H+)
D.由pH=7的溶液计算得:Ka=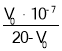 (V0是消耗的NaOH溶液的体积)
(V0是消耗的NaOH溶液的体积)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量铁和铝相混合,取等质量的混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
A.2mol/L HCl溶液B.5mol/L的NaOH溶液
C.4 mol/L HNO3溶液D.18mol/L的H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2以及 CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图:
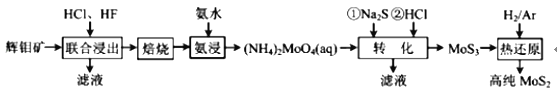
回答下列问题:
(1)(NH4)2MoO4中Mo的化合价为_____。
(2)“联合浸出”中HF除去的杂质化学式为_____,“焙烧”时MoS2转化为MoO3的化学方程式为_____。
(3)“转化”中加入Na2S后,(NH4)2MoO4转化为(NH4)2MoS4,写出(NH4)2MoS4与盐酸生成MoS3的离子方程式_____。
(4)由图分析产生MoS3沉淀的流程中应选择的最优温度和时间是_____,利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因_____。
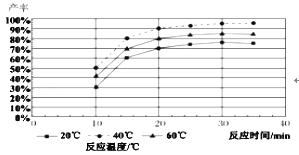
(5)高纯MoS2中存在极微量非整比晶体杂质MoS2.8,则该杂质中Mo4+与Mo6+的物质的量之比为_____。
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的 Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当SO42-完全沉淀时,溶液中c(MoO42-)<_____mol/L(保留2位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com