
【题目】真核细胞的RNA主要分布在( )
A. 细胞核 B. 细胞壁 C. 细胞膜 D. 细胞质
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2) 3的说法正确的是
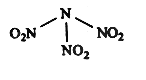
A.分子中N、O间形成的共价键是非极性键 B.分子中四个氮原子共平面
C.该物质既有氧化性又有还原性 D.15.2g该物质含有6.02×1022个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),这种元素的原子结构示意图为___________。
(2)④与⑤两种元素相比较,原子半径较大的是_______(填元素符号);在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是______(填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是_______(填化学式),具有两性的化合物是_______(填化学式)。
(3)③与⑥元素的氢化物的稳定性_________ 大于 __________(填化学式)。
(4)元素④和元素⑦形成化合物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
(5)⑦的氢化物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)若把长式元素周期表原先的主副族及族号取消,由左至右改为18列,如碱金属元素在第1列,稀有气体元素在第18列。按此规定,下列说法错误的是( )
A.第9列元素中没有非金属元素
B.只有第2列元素原子最外层有2个电子
C.第1列元素均为金属元素
D.在整个18列元素中,第3列的元素种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按原子个数比为1:1或2:1形成化合物;CB可与EA2反应生成C2A与气态物质EB4;E的M层电子数是K层电子数的2倍。
(1)写出下列元素的名称:B_________,E_____________。
(2)写出电子式:EB4__________。
(3)D2A2中含有的化学键为___________________________。
(4)由A、C、D三种元素组成的化合物M属于____(填“离子”或“共价”)化合物;M溶于水后______(填“是”或“否”)发生化学变化,原因是______________________(从化学键角度分析)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是
A.用铁电极电解NaNO3溶液的阳极反应式:4OH--4e-=O2+2H2O
B.HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++H++SO42-
D.用惰性电极电解AlCl3溶液的总反应离子方程式:2Cl-+2H2O![]() H2↑+ Cl2↑+2OH-
H2↑+ Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品:
仪器:试管、胶头滴管
药品:氯水、溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容):
序号 | 实验方案 | 实验现象 |
① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈__色 |
② | 向盛有少量碘化钾溶液的试管中滴加少量新制溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈__色 |
(4)实验结论:____________________。
(5)问题和讨论:
①上述两个实验中发生的反应的离子方程式分别为_________、________。
②由于氟过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯强:_______、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 在稀溶液中,1 mol酸和1 mol碱完全反应所放出的热量,叫做中和热
B. 在101 kPa时,1 mol物质燃烧时所放出的热量叫做该物质的燃烧热
C. 热化学方程式中,各物质前的化学计量数不表示分子个数
D. 如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。
已知:2NH3(g) ![]() N2 (g)+3H2(g) △H= 92.4 kJ·mol-1
N2 (g)+3H2(g) △H= 92.4 kJ·mol-1
2H2 (g)+O2 (g)=2H2O(g) △H= - 483.6 kJ·mol-1
NH3(l) ![]() NH3 (g) △H= 23.4 kJ·mol-1
NH3 (g) △H= 23.4 kJ·mol-1
(1) 4NH3(l)+3O2 (g)![]() 2N2(g)+6H2O(g) 的△H=______,该反应的平衡常数表达式为______。
2N2(g)+6H2O(g) 的△H=______,该反应的平衡常数表达式为______。
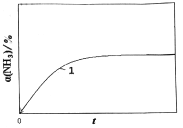
(2) 2NH3(g) ![]() N2(g)十3H2(g)能自发的条件是_________(填“高温”或“低温”);恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线1。如果保持其他条件不变,将反应温度提高到T2,请在图中再添加一条催化分解初始浓度也为c0的氨气过程中α(NH3)~t的总趋势曲线_________(标注2)。
N2(g)十3H2(g)能自发的条件是_________(填“高温”或“低温”);恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线1。如果保持其他条件不变,将反应温度提高到T2,请在图中再添加一条催化分解初始浓度也为c0的氨气过程中α(NH3)~t的总趋势曲线_________(标注2)。
(3)有研究表明,在温度大于70℃、催化剂及碱性溶液中,可通过电解法还原氮气得到氨气,写出阴极的电极反应式______________________。
(4) 25℃时,将amol/L的氨水与b mol/L盐酸等体积混合(体积变化忽略不计),反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com