
【题目】铝是地壳中含量最高的金属元素,其单质及化合物在生产生活中有广泛的应用。
(1)普通水泥的主要成分之一是铝酸三钙(3CaO·Al2O3),3CaO·Al2O3中Al的化合价为__________;
(2)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(Al2O3)与炭粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式__________;
(3)现将一定量的铝粉和镁粉的混合物与100mL稀硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐渐加入4mol·L-1的NaOH溶液,加入NaOH溶液的体积(mL)与产生沉淀的质量的关系如图所示。
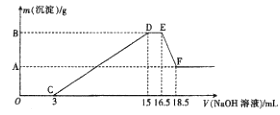
①D→E过程中反应的离子方程式为____________________;
②A点对应纵坐标的数值是__________,原稀硝酸的浓度是__________mol·L-1。
【答案】(1)+3 (2)Al2O3+3C+3Cl2![]() 2AlCl3+3CO
2AlCl3+3CO
(3)①NH4++OH-=NH3↑+H2O ②0.696 0.72
【解析】
试题分析:(1)根据化合物中各元素化合价代数和为零的原则,Al的化合价为+3价;
(2)根据题意知,反应物是氧化铝、碳和氯气,反应条件是加热,生成物是氯化铝和一氧化碳,所以其反应方程式为:Al2O3+3C+3Cl2![]() 2AlCl3+3CO;
2AlCl3+3CO;
(3)①由D点到E点,氢氧化钠溶液恰好和NH4NO3反应生成硝酸钠、一水合氨;离子方程式为:NH4++OH-=NH3↑+H2O;故答案为:NH4++OH-=NH3↑+H2O;
②由C与D点,氢氧化钠溶液恰好和Fe(NO3)3、Al(NO3)3反应生成NaNO3;
由D点到E点,氢氧化钠溶液恰好和NH4NO3反应生成硝酸钠、一水合氨通过上面的分析、根据氮原子守恒可知O点到D点硝酸钠的物质的量=硝酸的物质的量,从D点到E点硝酸的物质=2硝酸钠的物质的量,而硝酸钠的物质的量=氢氧化钠的物质的量,所以硝酸的物质的量=4mol/L×0.015L+2×4mol/L×(0.0165L-0.015L)=0.072mol,
所以原硝酸的物质的量浓度=![]() =0.72mol/L;
=0.72mol/L;
根据EF可知:沉淀减少,说明氢氧化铝溶解,所以氢氧化铝的物质的量=EF线段加入氢氧化钠溶液的物质的量
即:n[Al(OH)3]=4mol/L×(0.0185L-0.0165L)=0.008mol,
根据题意可知:生成0.008mol氢氧化铝沉淀消耗氢氧化钠的物质的量=3×0.008mol=0.024mol
CD段生成沉淀为氢氧化铝和氢氧化镁,
所以生成氢氧化镁消耗氢氧化钠的物质的量=4mol/L×(0.015L-0.003L)-0.024mol=0.024mol
n[Mg(OH)3]=![]() =
=![]() =0.012mol;纵坐标A点的数值即是生成氢氧化镁的质量=0.012mol×58g/mol=0.696g。
=0.012mol;纵坐标A点的数值即是生成氢氧化镁的质量=0.012mol×58g/mol=0.696g。


科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知铜是29号元素,写出Cu的价层电子排布式________,在元素周期表中的位置______,该元素在________(填“s”“p”“d”“f”或“ds”)区。
(2)写出与N同主族的As的基态原子的价电子排布图:______________。从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为________。
(3)写出Fe2+的核外电子排布式:________。
(4) 下列三种晶体:①CO2,②NaCl,③金刚石,它们的熔点从低到高的顺序____(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 1.8g18O2分子与1.8g18O3分子中含有的中子数不同
B. 7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA
C. 23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
D. 含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
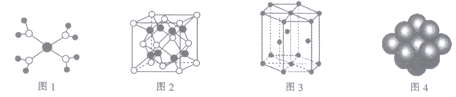
A. 水合铜离子的模型如图1所示,1个水合铜离子中含有4个配位键
B. K2O晶体的晶胞如图2所示,每个K2O晶胞平均占有8个O2-
C. 金属Zn中Zn原子堆积模型如图3所示,空间利用率为68%
D. 金属Cu中Cu原子堆积模型如图4所示,为面心立方最密堆积,每个Cu原子的配位数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、生产和社会可持续发展密切相关。下列说法正确的是( )
A. 往自来水中加入明矾进行杀菌消毒
B. 氮化硅陶瓷是一种新型的无机非金属材料
C. 在食品袋中放入硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质
D. 为提高农作物的产量和质量,应大量使用化肥和农药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子数和中子数相同的原子A,其阳离子An+核外共有x个电子,则A的质量数为( )
A. 2(x-n) B. 2(x+n) C. 2x D. n+2x
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修5:有机化学基础]
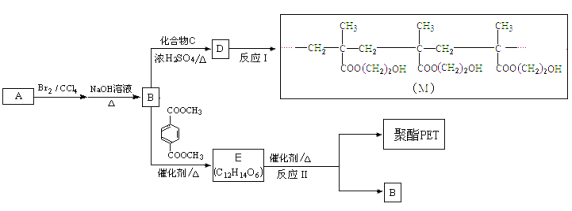
制作软质隐形眼镜高分子材料(M)和聚酯PET的合成路线如下:
已知酯与醇可发生如下酯交换反应:
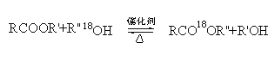 (R、R′、R″ 代表有机基团)
(R、R′、R″ 代表有机基团)
(1)A的相对分子质量是28,A、B分子中含有的官能团分别是 。
(2)B的名称是 。
(3)反应I的反应类型是_______(选填字母)。
a.加聚反应 b.缩聚反应
(4)有关B、C、D的说法正确的是 。
a.1mol B最多可以和1 mol C反应
b.C、D都能使Br2的CCl4溶液褪色
c.D与NaOH溶液共热后可以得到B和C
(5)B→D的化学方程式是 。
(6)C有多种同分异构体,其中一种是合成纤维维尼纶的单体,该分子在酸性环境下水解得到两种产物,它们的相对分子质量相差16,该同分异构体的结构简式是 。
(7)反应II的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
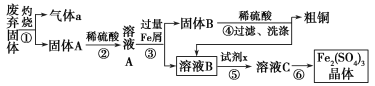
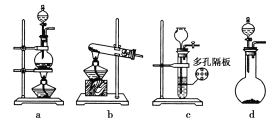
(1)③④操作中会有一种气体生成,若在实验室制备该气体,可选择下列哪些装置________。
(2)溶液B加稀硫酸酸化后加强氧化剂x,试剂x最好选择下列哪种试剂________(填序号)。
a.Cl2 b.H2O2 c.KMnO4
试剂x在酸性条件下与溶液B反应的离子方程式为_____________________________________。
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
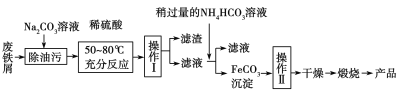
操作II的的名称是 ;
写出在空气中煅烧FeCO3的化学方程式_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
分别如下,其中反应速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com