
����Ŀ������β�������е�һ����Ӧ���£�2NO��g��+2CO��g��![]() N2��g��+2CO2��g����H=-373.4kJ/mol������Ӧ�ں��ݵ��ܱ������дﵽƽ��״̬�������й�˵����ȷ���ǣ�������
N2��g��+2CO2��g����H=-373.4kJ/mol������Ӧ�ں��ݵ��ܱ������дﵽƽ��״̬�������й�˵����ȷ���ǣ�������
A.�����������䣬�����������H���
B.���뺤��ʹ��ϵѹǿ������߷�Ӧ���ת����
C.��ʱ��ȥ������̼��������NO��ת��
D.�������¶ȣ��÷�Ӧ��ƽ�ⳣ������
 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ������ͼ��Ӱ���ֵ��ǣ� ��
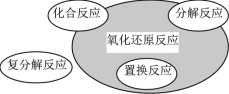
A.CO2��2Mg![]() 2MgO��C
2MgO��C
B.2NaCl��2H2O![]() 2NaOH��Cl2����H2��
2NaOH��Cl2����H2��
C.2NaHCO3![]() Na2CO3��CO2����H2O
Na2CO3��CO2����H2O
D.4Fe(OH)2��O2��2H2O��4Fe(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ص�����������ͼ���漰�����ӷ�Ӧ����ʽ��д������ǣ� ��
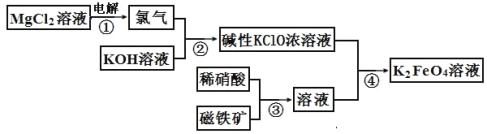
A. 2Cl-��2H2O![]() Cl2����H2����2OH-
Cl2����H2����2OH-
B. Cl2��2OH-��Cl-��ClO-��H2O
C. 3Fe3O4��28H+��NO3-��9Fe3+��NO����14H2O
D. 2Fe3+��3ClO-��10OH-��2FeO42-��3Cl-��5H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ֺ��ƻ�������ɵĻ����13.7�ˣ�����ˮ����μ���ijŨ�����ᣬ����CO2���������ɱ�״��������������������ϵ��ͼ��
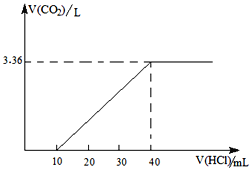
(1)������������ʵ���Ũ��Ϊ________________��
(2)���ֺ��ƻ�����Ļ�ѧʽ������֮��֮��Ϊ_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������������ε��ԭ����ͼ��ʾ���õ����MnSO4��ҺΪ���Һ��̼��ά��Pt/C�ֱ�Ϊ�缫���ϣ���ص��ܷ�ӦΪMn2��+ 2H2O![]() MnO2 + 2H��+ H2��������˵���������
MnO2 + 2H��+ H2��������˵���������
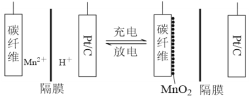
A. ���ʱ��̼��ά�缫������
B. ���ʱ��̼��ά�缫������Һ��pH����
C. �ŵ�ʱ��������Pt/C�缫����������̼��ά�缫
D. �ŵ�ʱ��������ӦʽΪMnO2 + 4H��+ 2e����Mn2��+ 2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ü���ij�ɳ���ص�ʾ��ͼ���õ�طŵ�Ļ�ѧ����ʽΪ2K2S2��KI3=K2S4��3KI��ͼ�е����ӽ���Ĥֻ����K��ͨ����C��D��F��Ϊʯī�缫��EΪͭ�缫������һ��ʱ��Ͽ�K����ʱC��D���缫���������������ͬ��E�缫�������� 1.28 g��

(1)װ�ü�A�缫Ϊ��ص�__��������ʵ�K����__(���ࡱ���Ҳࡱ)Ǩ�ƣ�B�缫�ĵ缫��ӦʽΪ____��
(2)װ������D�缫������������___�����Ϊ____mL(��״��)��
(3)����װ�ñ��е�NaCl��Һ�Ļ���FeCl2��FeCl3�Ļ����Һ���ӷ�Ӧ��ʼ����Ӧ��������װ����Һ�н������������ʵ���Ũ����ת�Ƶ��ӵ����ʵ����ı仯��ϵ��ͼ��ʾ��
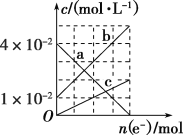
��ͼ��b��ʾ����_____(��������ӷ���)�ı仯���ߡ�
�ڷ�Ӧ����������0.5 mol��L��1NaOH��Һ������װ����Һ�еĽ���������(����Һ���Ϊ100 mL)����������Ҫ0.5 mol��L��1NaOH��Һ______mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���NaOH��Һ����ijһԪ�ᣨHA����Һ�У���û����Һ��pH������Ũ�ȱ仯��ϵ��ͼ��ʾ[��֪��![]() ]��������������ȷ����
]��������������ȷ����

A. Ka(HA)��������Ϊ10-5
B. �μ�NaOH��Һ�Ĺ����У�![]() ���ֲ���
���ֲ���
C. m����ʾ��Һ�У�c(H+)+c(Na+)=c(HA)+c(OH-)
D. n����ʾ��Һ�У�c(Na+)=c(A-)+c(HA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����д�������л����ϵͳ����
(1) 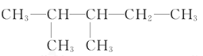 _____________
_____________
(2)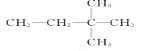 ______________
______________
II��д�������л�������Ľṹ��ʽ��
(3)2��2��3������3���һ����飺___________��
(4)2������3���һ����飺________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⼰�仯����������������Ӧ�ù㷺���ش���������:
��1�����ʵ������Ӧ�ɵ�IF5��ʵ�����Һ̬IF5����һ���ĵ�����ԭ������IF5����ż���루��:2H2O![]() H3O++OH-����IF5����ż���뷽��ʽΪ_________
H3O++OH-����IF5����ż���뷽��ʽΪ_________
��2���������ƺ͵������������Һ�еķ�Ӧ��:Na2SO3+KIO3+H2SO4 ��Na2SO4+K2SO4+I2+H2O��δ��ƽ���÷�Ӧ���̺ͻ����ϸ��ӣ�һ����Ϊ��Ϊ���²�:
��IO3-+SO32-��IO2-+SO42-������
��IO2-+SO32-��IO-+SO42-���죩
��5I-+6H++I03-��3I2+3H2O���죩
��I2+SO32-+H2O-��2I+SO42-+2H+���죩
�������������Ʋ⣬�˷�Ӧ���ܷ�Ӧ������_______����Ӧ����������ţ�����Ԥ�ȼ��˵�����Һ��������������_____________����������ʱ���Ż��е��۱��������������
��3�����ӵ���������Ҫ���о�����
����֪SO2��I2�ķ�Ӧ�����ʼ�����ƽ�ⳣ������Һ�д�������ƽ��:I2(aq)+l-(aq)=l3-(aq)�ֽ�1 mol SO2��ͨ�뺬1mol l2��ˮ��Һ����ǡ����ȫ��Ӧ��Һ��l3-�����ʵ���n(l3-)ʱ�䣨t���ı仯������ͼ1��ʾ����ʼ�Σ�n(l3-)�������ԭ����_____
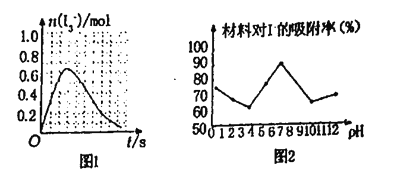
�ڿ���С�������Ͳ���Ag/TiO2����Һ�е����ӽ��������о�����ͼ2�Dz�ͬpH�����£�����������Ч���ı仯���ߡ��ݴ��ƶ�Ag/TiO2�������ʺ�����___________����������������������������������Һ�е�I-��
���Ȼ�������������Ҳ����Ч�����������Ȼ��������������Ե����ӵ�������ӦΪ:I-(aq)+AgCl(s)=Agl(s)+Cl-(aq)����Ӧ�ﵽƽ�����Һ��c(Cl-)=1.0mol��L-1.����Һ��c(I-)=______mol��L-1��k(AgCl)=2.0��10-10��k(Agl)=8.4��10-17��
��4��Fe3+��I-����Һ�з�����Ӧ:2Fe3++2I- ![]() 2Fe2++I2���÷�Ӧ������Ӧ���ʺ�Fe2+��I-��Ũ�ȹ�ϵΪv=k��cm(I-)��cn(Fe3+)������kΪ��������T��ʱ��ʵ����c��I-����c��Fe3+���뷴Ӧ���ʵĹ�ϵ���±���
2Fe2++I2���÷�Ӧ������Ӧ���ʺ�Fe2+��I-��Ũ�ȹ�ϵΪv=k��cm(I-)��cn(Fe3+)������kΪ��������T��ʱ��ʵ����c��I-����c��Fe3+���뷴Ӧ���ʵĹ�ϵ���±���
c��I-��/molL-1 | c��Fe3+��/molL-1 | v/molL-1s-1 | |
�� | 0.20 | 0.80 | 0.032k |
�� | 0.60 | 0.40 | 0.144k |
�� | 0.80 | 0.20 | 0.128k |
����v=k��cm(I-)��cn(Fe3+)��m��n��ֵΪ_____________������ţ�
A.m=1n=1 B.m=1��n=2 C.m=2��n=1 D.m=2��n=2
��I-Ũ�ȶԷ�Ӧ���ʵ�Ӱ��_____����������������С����������������Fe3+Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졣
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com