
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如下图所示)
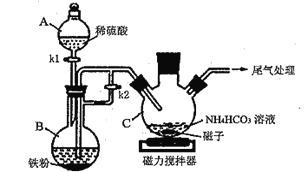
(1)仪器B的名称是__________________;实验操作如下:打开kl、k2,加入适量稀硫酸,关闭kl,使反应进行一段时间,其目的是__________________。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是____________,该反应产生一种常见气体,写出反应的离子方程式_________________________。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是__________。
Ⅱ.乳酸亚铁的制备及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在____________的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是_________________________。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000 g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液_____________________,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
【答案】蒸馏烧瓶 生成FeSO4溶液,且用产生的H2排尽装置内的空气 关闭k2 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 取最后一次洗涤液,加入稀盐酸酸化,再滴入BaCl2溶液,若无白色沉淀,则洗涤干净 隔绝空气 乳酸根离子中的羟基也能被高锰酸钾氧化,导致消耗高锰酸钾溶液用量偏多 蓝色褪去且半分钟不恢复 95.2%
【解析】
I.亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用反应生成的氢气排尽装置中的空气,B制备硫酸亚铁,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。C装置中硫酸亚铁和NH4HCO3发生反应产生FeCO3沉淀。
Ⅱ.Fe2+有较强还原性,易被空气中氧气氧化,获取乳酸亚铁晶体过程中应减小空气中氧气的干扰;①乳酸和亚铁离子都可被酸性高锰酸钾氧化;
②I2的淀粉溶液显蓝色,滴加硫代硫酸钠溶液后蓝色会变浅,最终褪色;根据已知反应可得关系式2Fe3+~~I2~~2S2O32-,根据滴定时参加反应的硫代硫酸钠的物质的量计算出Fe2+的物质的量,再计算样品纯度。
I.亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用反应生成的氢气排尽装置中的空气,装置B制备硫酸亚铁,C装置中硫酸亚铁和NH4HCO3发生反应:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。
(1)由仪器图形可知B为蒸馏烧瓶;打开kl、k2,加入适量稀硫酸,可使生成的氢气排出装置C内的空气,防止二价铁被氧化;
(2)待装置内空气排出后,再关闭k2,反应产生的氢气使装置内的气体压强增大,可将B中生成的硫酸亚铁溶液排到装置C中,发生反应生成碳酸亚铁,同时生成二氧化碳,反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(3)FeCO3是从含有SO42-的溶液中过滤出来的,检验沉淀是否洗涤干净,可通过检验是否含有SO42-判断。方法是:取最后一次水洗液于试管中,加入过量稀盐酸酸化,滴加一定量的BaCl2溶液,若无白色浑浊出现,则表明洗涤液中不存在SO42-,即可判断FeCO3沉淀洗涤干净;
Ⅱ.(4)Fe2+有较强还原性,易被空气中氧气氧化,则乳酸亚铁应隔绝空气,防止被氧化;
(5)①乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,Fe2+也可以被氧化,因此二者反应都消耗KMnO4溶液,导致消耗高锰酸钾的增大,使计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%;
②I2遇淀粉溶液显蓝色,滴加硫代硫酸钠溶液后蓝色会变浅,说明I2与Na2S2O3发生了氧化还原反应,当蓝色刚好褪去且半分钟不恢复,即可判断为滴定终点;24.80 mL0.1000mol/L硫代硫酸钠溶液中硫代硫酸钠的物质的量为n(Na2S2O3)=0.02480L×0.100mol/L=2.48×10-3mol,根据关系式2Fe2+~2Fe3+~I2~2S2O32-,可知样品中CH3CH(OH)COO]2Fe3H2O的物质的量为n(Fe2+)=n(S2O32-)=2.48×10-3mol×![]() =9.92×10-3mol,则样品的纯度为
=9.92×10-3mol,则样品的纯度为![]() ×100%=95.2%。
×100%=95.2%。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.235g核素![]() U发生裂变反应:
U发生裂变反应:![]() U+
U+![]() n
n![]()
![]() Sr+
Sr+![]() Xe+10
Xe+10![]() n,净产生的中子(
n,净产生的中子(![]() n)数为10NA
n)数为10NA
B.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
C.中子数为146、质子数为92的铀(U)原子:![]() U
U
D.![]() U和
U和![]() U是中子数不同、质子数相同的同种核素
U是中子数不同、质子数相同的同种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL 含Mg2+、Al3+、NH4+、H+、Cl- 、的溶液中,逐滴加入5 mol·L-1的NaOH溶液并微热,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示

(1)x-y=____________。
(2)加入33~35 mLNaOH溶液时的离子方程式:_________________________________。
(3)产生的氨气在标准状况下的体积_________________________mL。
(4)原溶液中n(Mg2+):n(Al3+)=______________________。
(5)原溶液中c(Cl-)=______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物F具有抗肿瘤、降血糖、降血压等多种生物活性,其合成路线如下:

已知:M的结构简式为: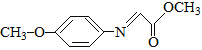 。
。
请回答下列问题:
(1)A的化学名称是_______________,B的化学式是________________。
(2)C中官能团的名称是__________________________。
(3)写出F的结构简式__________________________。
(4)已知A在一定条件下能生成可降解的聚酯,请写出该反应化学方程式:______________________________。
(5)满足下列条件的M的同分异构体有_______种(不含立体异构)。
① 能够发生银镜反应。
② 含有硝基(–NO2),且硝基直接连在苯环上。
③ 含有苯环且苯环上只有两个取代基。
其中核磁共振氢谱为四组峰且峰面积之比为6∶2∶2∶1的结构简式为________(写出一种即可)。
(6)写出用乙醛为原料制备高分子化合物聚丙烯腈的合成路线(无机试剂任选):______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图完成一氧化氮与过氧化钠反应制备亚硝酸钠(2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3,NO能被酸性KMnO4溶液氧化为NO3-),下列说法错误的是

A.检查装置气密性后,应先打开止水夹,从导管中通入N2
B.装置C是用来吸收CO2的
C.D管中可能含有的杂质为NaNO3、NaOH
D.装置E用于处理尾气,反应中氧化剂与还原剂的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
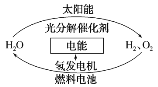
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.氢气不易贮存和运输,无开发利用价值
D.2 mol H2O具有的总能量低于2 mol H2和1 mol O2具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2),又称碳酰氯,常温下为无色气体,剧毒。化学性质不稳定,反应活性较高,常用作合成农药、药物、染料及其他化工产品的中间体。氯仿(CHCl3)被氧化可产生光气2CHCl3+O2→2HCl+2COCl2。下列说法正确的是( )
A.CHCl3的立体构型为正四面体
B.COCl2为平面型分子,中心C原子采用sp2杂化
C.CHCl3和COCl2分子中所有原子的最外层电子都满足8电子稳定结构
D.CHCl3是手性分子,存在手性异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、环境有着密切的关系。
(1)光导纤维的主要成分是_________(填化学式)
(2)工业上制造水泥、玻璃和高炉炼铁都要用到的原料是________(填字母)
A.纯碱 B.石英 C.黏土 D.石灰石
(3)铝元素在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制。铝及其化合物在下列场合使用时必须严格加以控制的是________(填字母)
A.用明矾净水 B.制电线电缆 C.制包糖果用的铝箔 D.制防锈油漆
(4)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜(氧化物)遇到强酸或强碱都会溶解,请写出氧化膜与氢氧化钠溶液反应的化学方程式:_____________________
(5)工业上从海水中提取溴单质,可向海水中通入Cl2,将其中的溴化物氧化,离子方程式为____________________
(6)如图为实验室中盐酸试剂瓶标签上的部分内容。试回答下列问题:

①该盐酸的c(HCl)为_________ mol/L
②欲用该盐酸配制1.19 mol/L的盐酸480 mL。完成下列有关操作中的空白。
a.用_________(填实验仪器名称)准确量取盐酸,注入烧杯中,加入适量的水,混合均匀;
b.将操作a所得的盐酸沿玻璃棒注入_________mL容量瓶中;
c.用适量的水洗涤烧杯、玻璃棒2~3次,洗涤液均注入容量瓶中,振荡;
d.缓缓地将蒸馏水注入容量瓶中,直到瓶中的液面接近容量瓶的刻度线l~2cm处,改用_______________加蒸馏水至溶液的凹液面正好与刻度线相切;
e.将容量瓶盖好,反复上下颠倒摇匀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以物质A为原料,制备物质D(金刚烷)的合成路线如图所示:
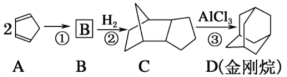
关于以上有机物说法中错误的是( )
A.物质A最多有10个原子共平面
B.物质C与物质D互为同分异构体
C.物质D的一氯代物有2种
D.反应①、②均为加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com