
| A、恒温,压缩体积,平衡不移动,混合气体颜色加深 |
| B、恒压,充入HI(g),开始时正反应速率减小 |
| C、恒容,升高温度,正反应速率减小 |
| D、恒容,充入H2,I2(g)的体积分数降低 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
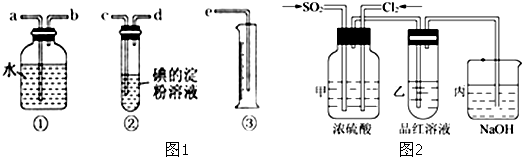
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
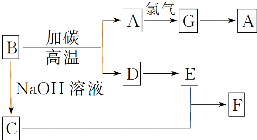 如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.
如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.查看答案和解析>>
科目:高中化学 来源: 题型:
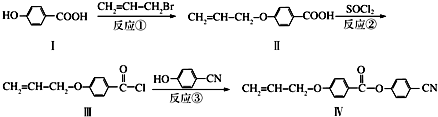
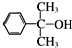 也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
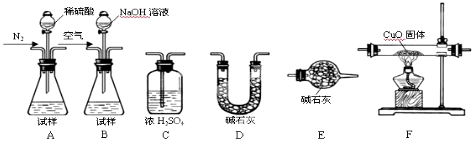
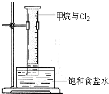
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com