


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
| A、Na2CO3═2Na++CO32- |
| B、NaHCO3═Na++HCO3- |
| C、H2SO4═2H++SO42- |
| D、KClO3═K++Cl-+3O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
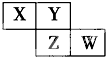 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A、原子半径:W>Z>Y>X |
| B、最高价氧化物对应水化物的酸性:Z>W>X |
| C、与H2化合,Z比W更容易 |
| D、形成的气态氢化物溶于水,溶液呈碱性的是:X |
查看答案和解析>>
科目:高中化学 来源: 题型:
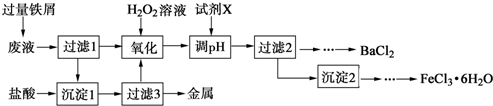
查看答案和解析>>
科目:高中化学 来源: 题型:
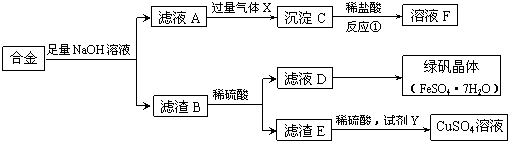
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | 离子浓度关系 | |
| A | pH<7 | c(CH3COO-)>c(CH3COOH) |
| B | pH>7 | c(CH3COO-)<c(CH3COOH) |
| C | pH=7 | c(CH3COO-)=c(CH3COOH) |
| D | pH<7 | c(CH3COO-)<c(CH3COOH) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
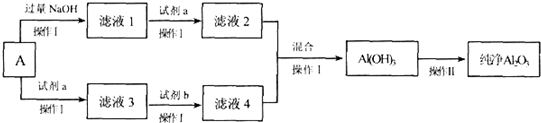
查看答案和解析>>
科目:高中化学 来源: 题型:
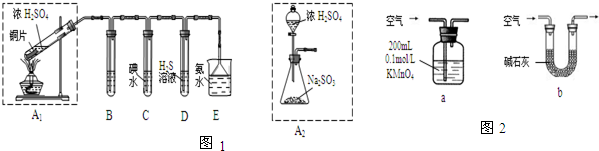
查看答案和解析>>
科目:高中化学 来源: 题型:
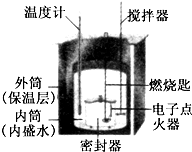 某化学兴趣小组将两份等质量的硫粉分别在空气、氧气中燃烧,放出的热量是一样多还是不一样多?经过讨论、综合,根据观点分成了两组.
某化学兴趣小组将两份等质量的硫粉分别在空气、氧气中燃烧,放出的热量是一样多还是不一样多?经过讨论、综合,根据观点分成了两组.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com