
【题目】Ⅰ.将等质量的锌片和铜片用导线相连并插入500 mL CuSO4溶液中构成如图所示的装置。
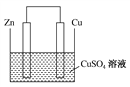
(1)该装置为________装置,该装置中发生反应的离子方程式为______________,铜片周围溶液会出现________的现象。
(2)若锌2 min后的质量减少1.3 g,则导线中流过的电子为________mol。
(3)若将该装置的电解质溶液换为FeCl3溶液,其正极反应为____________________。
Ⅱ.向2 L的密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应xA(g)+yB(g) pC(g)+qD(g)。已知:平均反应速率v(C)=![]() v(A);反应至2 min时,A的物质的量减少了
v(A);反应至2 min时,A的物质的量减少了![]() ,B的浓度减少了
,B的浓度减少了![]() a mol·L-1,同时有a mol D生成。
a mol·L-1,同时有a mol D生成。
(1)0~2 min内,v(A)=________。
(2)该化学方程式中,y=________。
(3)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较,反应速率_______(填“增大”、“减小”或“不变”),理由是_______________。
【答案】 原电池 Zn+Cu2+===Zn2++Cu 颜色变浅 0.04 Fe3++e-===Fe2+ ![]() a mol/(L·min) 3 增大 体积减小,反应物的浓度增大,则反应速率增大
a mol/(L·min) 3 增大 体积减小,反应物的浓度增大,则反应速率增大
【解析】本题分析:本题主要考查化学方程式中物质反应速率之间的关系。
(1)该装置为原电池,该装置中发生反应的离子方程式为Zn+Cu2+===Zn2++Cu,由于蓝色离子Cu2+的消耗,铜片周围溶液会出现颜色变浅的现象。
(2)Zn~ 2e-,若2 min后锌的质量减少1.3 g即0.02mol,则导线中流过的电子为0.04mol。
(3)若将该装置的电解质溶液换为FeCl3溶液,正极发生还原反应,其正极反应为Fe3++e-===Fe2+。
Ⅱ(1)0~2 min内,v(A)=![]() amol/2L/2min=
amol/2L/2min= ![]() a mol/(L·min) 。
a mol/(L·min) 。
(2)A的物质的量减少了![]() a mol,B的物质的量减少了
a mol,B的物质的量减少了![]() a mol·L-1×2L=
a mol·L-1×2L=![]() a mol,生成a molD,v(C)=
a mol,生成a molD,v(C)=![]() v(A),生成
v(A),生成![]() a molC ,x:y:p:q=4:3:2:6,所以y=3。
a molC ,x:y:p:q=4:3:2:6,所以y=3。
(3)如果其他条件不变,将容器的容积变为1 L,就是加压,反应速率增大,理由是体积减小,反应物的浓度增大,则反应速率增大。


科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
I.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

(1)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是_________;装置III中溶液逐渐褪色,证明二氧化硫具有___________性。
(2)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40 mL 3.0mol/L NaOH溶液,反应后增重5.12 g,则装置Ⅳ中发生反应的化学方程式是_______________。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量________(填字母),便能产生沉淀。
A.硫化钠溶液 B.氨水 C.盐酸 D.硝酸钾溶液
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
称取铁钉(碳素钢)6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(4)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用________(填序号)。
a.KSCN溶液和氯水 b.氢氧化钠溶液
c.酸性KMnO4溶液 d.铁粉和KSCN溶液
(5)乙同学取784mL(标准状况)气体Y通入足量H2O2水溶液中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积百分数为____________。(保留小数点后一位)
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和CO2气体,产生CO2的理由是_______________(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中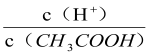 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不![]() 变
变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO的一种制备流程图如下:
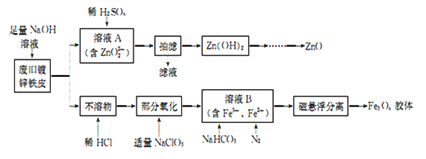
(1)用NaOH溶液处理废旧锌铁皮发生反应的化学方程式为____________。
(2)①若溶液A中滴加稀H2SO4过量,会溶解产生的Zn(OH)2,可改用的方法是____________。
②由Zn(OH)2灼烧制ZnO前需进行洗涤,检验沉淀洗涤是否干净的方法是______________。
(3)流程中加人NaC1O3发生反应的离子方程式为______________。
(4)①由溶液B制得Fe3O4胶体粒子的过程中通入N2的原因是____________。
②溶液B中主要发生的离子反应方程式为________________。
③确定溶液B中含有Fe2+的实验方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),这种元素的原子结构示意图为___________。
(2)④与⑤两种元素相比较,原子半径较大的是_______(填元素符号);在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是______(填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是_______(填化学式),具有两性的化合物是_______(填化学式)。
(3)③与⑥元素的氢化物的稳定性_________ 大于 __________(填化学式)。
(4)元素④和元素⑦形成化合物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
(5)⑦的氢化物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知可逆反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O,设计如下图装置,进行下述操作:
AsO33-+I2+H2O,设计如下图装置,进行下述操作:
①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反。回答下列问题

(1)操作①过程中,C1棒为__________极,C2棒上发生的反应为______________________
(2)操作②过程中盐桥中的_________离子移向(I)烧杯,C1棒上发生的反应为_____________
(3)若将微安表换成电解冶炼铝装置,写出电解总反应方程式__________________________________
(4)若将微安表换成电解精炼铜装置,在操作②过程中与C2棒连接的为_________电极,电解一段时间后,溶液中CuSO4溶液的浓度_____________(填“变大”“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)若把长式元素周期表原先的主副族及族号取消,由左至右改为18列,如碱金属元素在第1列,稀有气体元素在第18列。按此规定,下列说法错误的是( )
A.第9列元素中没有非金属元素
B.只有第2列元素原子最外层有2个电子
C.第1列元素均为金属元素
D.在整个18列元素中,第3列的元素种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是
A.用铁电极电解NaNO3溶液的阳极反应式:4OH--4e-=O2+2H2O
B.HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++H++SO42-
D.用惰性电极电解AlCl3溶液的总反应离子方程式:2Cl-+2H2O![]() H2↑+ Cl2↑+2OH-
H2↑+ Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 原子最外层电子数是内层电子总数的1/5 |
B | 形成化合物种类最多的元素,其单质为固体 |
C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
D | 地壳中含量最多的元素 |
E | 与D同主族 |
F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是_______________;A与E形成的化合物的电子式是 ________。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是_________。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是______。
(4) F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com