
原电池正、负电极的名称不仅与电极材料的性质有关,也与电解质溶液有关.下列由不同材料组成的原电池,电极反应正确的是( )
A.由Fe、Cu与稀硫酸溶液组成的原电池,其负极反应式为:Fe﹣3e﹣═Fe3+
B.由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为:Mg﹣2e﹣+2OH﹣═Mg(OH)2
C.由Pb、Cu与氯化铁溶液组成的原电池,其正极反应式为:Cu﹣2e﹣═Cu2+
D.由Al、Cu与浓硝酸组成的原电池,其负极反应式为:Cu﹣2e﹣═Cu2+
考点:
原电池和电解池的工作原理. .
专题:
电化学专题.
分析:
A.由Fe、Cu与稀硫酸溶液组成的原电池,铁易失电子作负极,铜作正极;
B.由Al、Mg与氢氧化钠溶液组成的原电池,该条件下,铝易失电子而作负极,镁作正极;
C.由Pb、Cu与氯化铁溶液组成的原电池,铜易失电子而作负极,铂作正极;
D.由Al、Cu与浓硝酸组成的原电池,该条件下,铜易失电子而作负极,铝作正极;
负极上失电子发生氧化反应,正极上得电子发生还原反应.
解答:
解:A.由Fe、Cu与稀硫酸溶液组成的原电池,铁易失电子作负极,铜作正极,负极电极反应式为:Fe﹣2e﹣═Fe2+,故A错误;
B.由Al、Mg与氢氧化钠溶液组成的原电池,该条件下,铝易失电子而作负极,镁作正极,负极反应式为:Al﹣3e﹣+3OH﹣═Al(OH)3,故B错误;
C.由Pb、Cu与氯化铁溶液组成的原电池,铜易失电子而作负极,铂作正极,正极上铁离子得电子发生还原反应,电极反应式为:Fe 3++e﹣═Fe 2+,故C错误;
D.由Al、Cu与浓硝酸组成的原电池,该条件下,铜易失电子而作负极,铝作正极,负极上电极反应式为:Cu﹣2e﹣═Cu2+,故D正确;
故选:D.
点评:
本题考查了原电池正负极的判断,根据电极上得失电子来判断正负极,不能根据金属的活泼性强弱来确定正负极,为易错点.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
下列有关化学实验叙述正确的是
A.容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水
B.用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶
C.在钠跟水反应的实验中,切下绿豆粒大小的钠投入水中进行实验,剩余的钠块丢弃到废料桶中
D.若FeCl2溶液中含有I-杂质,可用过量Cl2氧化后进行萃取分液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列哪种说法可以证明反应.N2+3H2 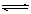 2NH3已达到平衡状态 ( )
2NH3已达到平衡状态 ( )
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有2个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
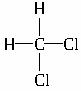
 下列各组物质中属于同系物的是________,互为同分异构体的是________,互为同素异形体的
下列各组物质中属于同系物的是________,互为同分异构体的是________,互为同素异形体的
是________,互为同位素的是________,
属于同一物质的是_ _______。
①C(CH3)4和C4H10 ② 和
③35Cl和37Cl ④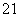 H2O和
H2O和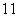 H2O
H2O
⑤石墨和金刚石 ⑦(CH3)2CHCH(CH3)2
和 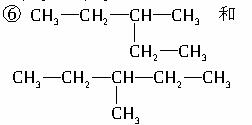 (CH3)2CH(CH2)2CH3
(CH3)2CH(CH2)2CH3
⑧H2 D2 T2 ⑨麦芽糖和蔗糖
⑩硬脂酸甘油酯和油酸甘油酯
⑪CH2=CH-CH2CH3 和 CH3-CH=CH-CH3 ⑫纤维素与淀粉
查看答案和解析>>
科目:高中化学 来源: 题型:
美国斯坦福大学研究人员发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl.下列有关“水”电池在海水中放电时的说法正确的是( )
|
| A. | 负极反应式:Ag+Cl﹣+e﹣═AgCl |
|
| B. | 电池的正极用二氧化锰纳米棒为材料,可大大提高发电效率 |
|
| C. | Na+不断向“水”电池的负极移动 |
|
| D. | 每转移2 mol电子,正极就有5 mol MnO2被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
目前市场上的手提应急灯,主要用的是“无液干粉”铅酸蓄电池,其原理是将强腐蚀性的浓硫酸灌注到硅胶中,使电解质溶液不易发生泄漏,大大改善了电池的性能.所用的原料仍然是Pb﹣PbO2﹣H2SO4,下列关于该铅酸蓄电池的说法正确的是( )
|
| A. | 充电时,电源的正极接蓄电池标“+”的一极,电池上标有“﹣”的一极发生氧化反应 |
|
| B. | “无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理 |
|
| C. | 放电时,在铅酸蓄电池的负极发生还原反应 |
|
| D. | 若用此铅酸蓄电池电解饱和NaCl溶液,标准状况下制备1.12LCl2,电池内至少消耗H2SO40.10 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. 在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 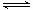 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12[来源:Z§xx§k.Com] | 0.11 | 0.10 | 0.10 |
(1)反应前2min的平均速率ν(Z)= ,该温度下此反应的平衡常数K=
(2)其他条件不变,若降低温度,反应达到新平衡前ν(逆) ν(正) (填“>”,“<”或“=”)
(3)其他条件不变,若再充入0.2molZ,平衡时X的体积分数 (填“增大”,“减小”或“不变”)
Ⅱ. 某电解池装置如下图所示:
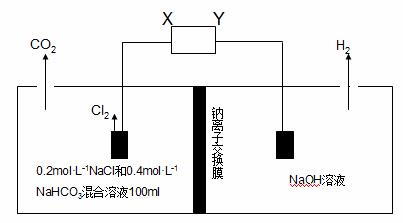
(1)外电源的负极是 (填“X”或“Y”)
(2)阳极室中发生的反应依次为 ,
(3)若外电路转移0.02mol电子,则膜两侧溶液质量变化差△m左 – △m右= g
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置制取、干燥并收集选项中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的( )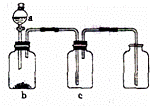
| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | Cu | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀盐酸 | CaCO3 | 浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com