
【题目】用杂化理论描述CCl4的生成和分子构型.
【答案】在CCl4分子中,C:2s22p2,用sp3杂化,和四个Cl的p轨道形成四个等同的σ键,分子构型为正四面体
【解析】解:C所含质子数为6,原子核外电子数为6,原子核外电子排布为:1s22s22p2,Cl所含质子数为17,原子核外电子数为17,核外电子排布式为1s22s22p63s23p5,在CCl4分子中,基态C原子中已配对的2s电子拆开,一个电子由2s轨道跃迁到2p轨道上,一个2S轨道和3个2P轨道杂化,生成4个能量相等的sp3杂化轨道,再与4个Cl原子中的p电子配对成σ键,分子构型为正四面体,
故答案为:在CCl4分子中,C:2s22p2,用sp3杂化,和四个Cl的p轨道形成四个等同的σ键,分子构型为正四面体.
CCl4中一个碳原子一个电子由2s轨道跃迁到2p轨道上杂化,再与4个Cl原子中的p电子配对成σ键,一个碳原子周围与4个氯原子相连,各原子满足8电子稳定结构,电子式为  ,CCl4中C原子有4个σ键电子对数,所以C的杂化方式为sp3杂化,分子构型为正四面体.
,CCl4中C原子有4个σ键电子对数,所以C的杂化方式为sp3杂化,分子构型为正四面体.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】组成人体细胞的主要元素含量占细胞鲜重的百分比前6位依次为( )
A. C、H、O、N、P、S B. C、O、N、H、P、S
C. O、C、H、N、P、S D. C、O、N、H、S、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Al3+、Fe3+、Cu2+、NO3-、CO32-、SO42-):现取两份100mL溶液进行如下实验:
①第一份加入足量的BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,称量沉淀质量为4.66g;
②第二份逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如图所示。

根据上述实验事实,回答以下问题:
(1)该溶液中一定不存在的阳离子有_____和______。
(2)在实验②中,NaOH溶液滴至b~c段过程中发生的离子反应方程式为___________;NaOH溶液的浓度为_____(用字母c、d表示);
(3)原溶液确定含有Mg2+、Al3+、H+,其物质的量之比n(Mg2+):n(Al3+):n(H+)为_____;
(4)原溶液中NO3-的浓度为c(NO3-),则c(NO3-)的取值范围______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是100mg CaC2O4H2O受热分解时,所得固体产物的质量随温度变化的曲线.试利用图中信息结合所学的知识,回答下列各问题: 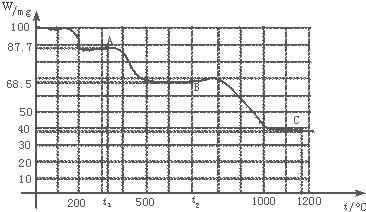
(1)温度分别为t1和t2时,固体产物的化学式A是 , B是 .
(2)由CaC2O4H2O得到A的化学方程式为 .
(3)由A得到B的化学方程式为 .
(4)由图计算产物C的相对分子质量,并推断C的合理的化学式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,将2.0mol CO与10mol H2O混合加热到800℃,达到下列平衡:CO(g)+H2O(g)CO2(g)+H2(g) K=1.0 则CO转化为CO2的转化率( )
A.83%
B.17%
C.50%
D.60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH.则电解过程中转移的电子数为( )
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯,简称SM,是石化行业的重要基础原料,主要用于生产苯乙烯系列树脂及丁苯橡胶。苯乙烯能发生如下一系列变化。下列说法不正确的是

A. 有机物SM能使溴的四氯化碳溶液褪色
B. 有机物I能与金属钠反应放出H2
C. 有机物I、II均能发生氧化反应和加成反应
D. 有机物I的同分异构体中,苯环上只有一个烃基且含有碳碳双键的结构有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度.实验步骤:①配制500mL浓度约为0.1molL﹣1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度.
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解.该配制步骤(填“可行”或“不可行”).
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期(填“小”或“大”),这是不能直接配制其标准溶液的原因.
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为 molL﹣1 , 滴定前将白醋稀释(填“10”或“100”)倍.(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、 .
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至即为终点. 重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c molL﹣1).
(6)原白醋中醋酸的物质的量浓度=molL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com