
【题目】海水中含有大量C1-、Na+及少量SO42-、Ca2+、Mg2+,用电渗析法对该海水样品进行淡化处理,如图所示。下列说法错误的是
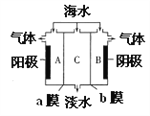
A. a膜是阴离子交换膜
B. A极室产生的气体可使湿润的KI淀粉试纸变蓝
C. B极室产生气泡并伴有少量沉淀生成
D. 淡化工作完成后A、B、C三室中pH大小为pH(B)
科目:高中化学 来源: 题型:
【题目】二氧化硫、二氧化碳、三氧化硫同时具备的性质是( )
A. 都能使品红试液褪色 B. 都能和氢氧化钠溶液反应生成盐和水 C. 都有刺激性气味 D. 常温下都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象因发生取代反应而产生的是 ( )
A.乙烯使溴的四氯化碳溶液褪色
B.将苯加人溴水中,振荡后水层接近无色
C.甲烷与氯气混合,光照一段时间后黄绿色消失
D.乙烯使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是

A.③元素形成的单质晶体均属于原子晶体
B.②、⑦、⑧对应的简单离子半径依次减小
C.②⑤形成的化合物阴阳离子个数比可能为1∶1
D.④元素的气态氢化物易液化,是因为其分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,所克服的微粒间的相互作用属于同种类型的是( )
A. 氢氧化钠和葡萄糖分别溶解在水中 B. 液溴和四氯化碳分别挥发
C. 食盐和冰分别受热熔化 D. 干冰和氯化铵分别受热变为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常见的A-J物质存在如下转化关系示意图(反应条件己略去),
已知通常情况下A、H 为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀.请回答下列问题:
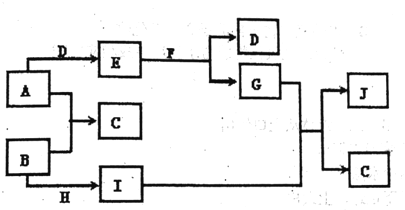
(1)写出下列物质的化学式:A_____;C____; J ______;
(2)转化I+G![]() J+C的反应类型为______。
J+C的反应类型为______。
(3)E中阴阳离子个数比与_______相同(填字母)
a.MgCl2 b.Na2O c.NaCl d.K2SO4
(4)写出下列反应的化学方程式:
① E+F![]() ________;
________;
② B+G![]() _________。
_________。
(5)写出E的一种用途:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中存在有五种离子,其中各离子个数比Cl-∶SO42-∶Fe3+∶K+∶M=2∶3∶1∶3∶1,则M为( )
A.CO32- B.Mg2+ C.Na+ D.Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 酸性高锰酸钾溶液可用来鉴别乙烷和乙烯
B. 烃分子中都含有极性键和非极性键
C. ![]() 分子中至少11个碳原子处于同一平面
分子中至少11个碳原子处于同一平面
D. 利用灼烧的方法可鉴别蚕丝和棉制品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用O2将HCl转化为Cl2,可提高效益,减少污染,(1)传统上该转化通过如右图所示的催化剂循环实现,

其中,
反应①为2HCl(g)+CuO(s)![]() H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1 mol Cl2的反应热为△H2,则总反应的热化学方程式为_______________________(反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl-T曲线如图所示,则总反应的△H_____0 ,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是_______________。

②在上述实验中若压缩体积使压强增大,画出相应ɑHCl~T曲线的示意图,并简要说明理由__________。
(3)①下列措施中有利于提高ɑHCl的有_____________。
A.增大n(HCl) B.增大n(O2) C.使用更好的催化剂 D.移去H2O
②一定条件下测得反应过程汇总n(Cl2)的数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0 min内以HCl的物质的量变化表示的反应速率为_______________(以mol·min-1为单位)。
(4)Cl2用途广泛,写出Cl2制备漂白粉的化学方程式__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com