
【题目】气相条件下,立方烷能自发地发生热重排反应生成一系列化合物。下列说法正确的是
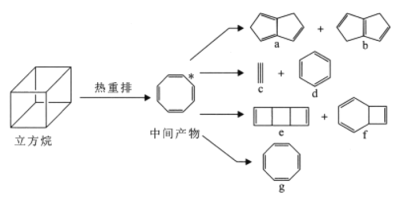
A.a、f中所有原子均可处于同一平面
B.1mol化合物e完全燃烧消耗12molO2
C.六硝基立方烷最多有3种结构(不考虑立体异构)
D.立方烷热重排产物均能使酸性KMnO4溶液褪色
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

(1)通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为__________________ 、______________________,制得等量H2所需能量较少的是___________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率a1=_____ %,反应平衡常数K =___________。
②在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率a2 _____________a1,该反应的H __________0。(填“>” “<” 或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是 _____ (填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物9,10-二甲基菲的结构如图所示,下列关于该物质的说法正确的是

A. 该物质分子式为C16H12
B. 该物质与甲苯互为同系物
C. 该物质能与溴水发生取代反应和加成反应
D. 该物质苯环上七氯代物的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从1.0 mol·L-1氢氧化钠溶液中取出100 mL,则这100 mL氢氧化钠溶液:
(1)物质的量浓度是________;
(2)所含氢氧化钠的质量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH4、CO2为原料合成乙酸,是综合开发温室气体资源的新方向。
I.CH4.CO2催化重整间接制乙酸
CH4、CO2催化重整制合成气,再利用合成气制乙酸,涉及的反应如下:
反应l:CH4(g)+CO2(g) 2H2(g)+2CO(g)△H
反应2:2H2(g)+CO(g) CH3OH(g)△H=-90.9kJ·mol-1
反应3:CH3OH(g)+CO(g) CH3COOH(g)△H=-118.2kJ·mol-1
(1)已知:CH4(g)+CO2(g) CH3COOH(g)△H=+37.9kJ·mol-1则“反应l”的△H=_________
(2)“反应1”的化学反应速率v=k[![]() ]m·[
]m·[![]() ]n,k为速率常数。1123K和1173K时,分别保持
]n,k为速率常数。1123K和1173K时,分别保持![]() 或
或![]() 不变,测得速率v与
不变,测得速率v与![]() 、
、![]() 的关系如图所示:
的关系如图所示:
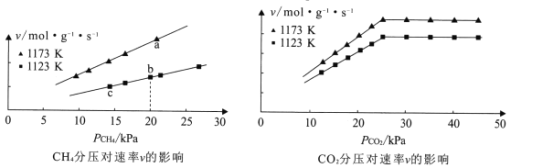
①由图可知,下列叙述正确的是_________(填标号)。
A.当10kPa≤![]() ≤25kPa时,m=l
≤25kPa时,m=l
B.其他条件不变,增大![]() ,速率v不一定增大
,速率v不一定增大
C.a、b、c三点速率常数的大小关系为:ka>kb>kc
②若初始时按n(CH4):n(CO2)=1:1进气,且Kb=1.3×10-2mol·g-1·s-1·Kpa-2,则b点的化学反应速率v=_________mol·g-1·s-1。
(3)向盛有催化剂的刚性容器中通入等物质的量的CH4(g)和CO2(g),发生“反应1”。在923K和1173K时,CH4(g)的转化率(α)与时间(t)的关系如图所示。
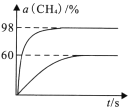
923K时,CH4(g)的平衡转化率α=_________,若平衡时体系的总压强为p0,平衡常数K923K=____(用含有p0的代数式表示)。
II.CH4、CO2两步法制乙酸
(4)反应CH4(g)+CO2(g)CH3COOH(g)不能自发进行。将该反应拆分成两个连续的步骤进行,可在较温和的条件下实现上述转化,具体过程:
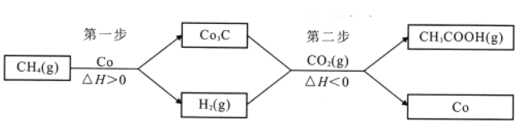
①第二步反应的化学方程式为_________
②为增大CH3COOH的平衡产率,从温度角度考虑,第一步反应在高温下进行,第二步反应在_________进行;从H2浓度的角度考虑,应采取的措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热△H = -890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g) + 2O2(g)═ CO2(g) + 2H2O(g) △H = -890.3kJ/mol
B.一定条件下,将0.5mol N2和1.5m01H2置于密闭容器中充分反应生成NH3放热19.3kJ其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H =-38.6kJ/mol
2NH3(g) △H =-38.6kJ/mol
C.在l01kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g) + O2(g)═2H2O(l) △H =-571.6kJ/mol
D.HCl和NaOH反应的中和热△H = -57.3kJ/mol,则H2SO4和Ca(OH)2反应的反应热△H = 2×(-57.3)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、M、E、Q均为稀有气体外的短周期元素,,其原子序数依次增大,X的最外层电子数是W的4倍,Z与E的最低负化合价相同,X、M在周期表的位置如图。
X | ||
M | E |
(1)Y在周期表中的位置为________,Q的元素名称为_______。
(2)X的最高价氧化物的电子式为____________________;Y和W形成的五核离子的电子式为_________________。
(3)表中元素原子半径最大的是(写元素符号)________。
(4)X与E的最高价氧化物的水化物反应的化学反应式为___________________________。
(5)下列事实能说明Z元素的非金属性比E元素的非金属性强的是________
①Z单质与E的简单氢化物的溶液反应,溶液变浑浊
②在氧化还原反应中,1mol Z单质比1mol E单质得电子多
③Z和E两元素的简单氢化物受热分解,前者分解温度高
(6)M和Q两元素的单质生成1mol M的最高价化合物,恢复至室温,放热687kJ。已知该化合物的溶沸点分别为—69℃和58℃,写出该反应的热化学方程式:_________
(7)铜与一定浓度的硝酸和硫酸的混酸反应,生成的盐只有硫酸铜,同时生成的两种气体由以上元素中的两种元素组成。气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸,消耗1L 2.2mol/L NaOH溶液和1mol O2,则两种气体的分子式以及物质的量分别为____________________,生成的硫酸铜的物质的量为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝绿色 | 有无色气泡产生 |
以下结论不正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中发生的反应是离子反应
D.Ⅲ中发生反应的离子方程式为2H++Zn=Zn2++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com