
����Ŀ����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿�������������д�ʵ�飬����������ͼ��ʾ��
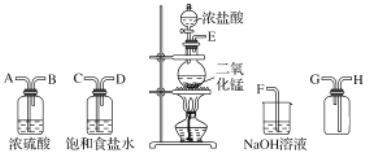
��1������������������ȷ˳������ӿڴ�����ĸ����____ ��____��____��____��____��_____��____��____��
��2��װ���У�����ʳ��ˮ��������________��NaOH��Һ��������_______��
��3����ѧʵ���г���ʪ��ĵ��ۣ�KI��ֽ�����Ƿ���Cl2�����������Cl2�������ɹ۲쵽_____����Ӧ�Ļ�ѧ����ʽΪ________��
��4��д�����з�Ӧ�����ӷ���ʽ��
�����巢��װ���н��еķ�Ӧ��____��
��NaOH��Һ�з����ķ�Ӧ��________��
���𰸡�E C D A B H G F ��ȥCl2�е�HCl ����β�� ����KI��ֽ���� 2I+Cl2=I2+2Cl MnO2+4H++2Cl-��Ũ��![]() Mn2++Cl2��+2H2O Cl2+2OH-=Cl-+ClO-+H2O
Mn2++Cl2��+2H2O Cl2+2OH-=Cl-+ClO-+H2O
��������
��Ũ����Ͷ��������ڼ��������·�Ӧ����������Ũ������лӷ��Ե������ɵ������к���HCl������ʳ��ˮ������HCl�����������ܽ⣬�����ñ���ʳ��ˮ��ȥ�����е�HCl����Ũ������������������ܶȴ��ڿ����ҺͿ�������Ӧ�����������ſ������ռ������������ж�����ֱ���ſգ��������ܺͼӦ�����κ�ˮ����������ü�Һ����β�����ݴ˽��
(1)��Ũ����Ͷ��������ڼ��������·�Ӧ����������Ũ������лӷ��Ե������ɵ������к���HCl������ʳ��ˮ������HCl�����������ܽ⣬�����ñ���ʳ��ˮ��ȥ�����е�HCl����Ũ������������������ܶȴ��ڿ����ҺͿ�������Ӧ�����������ſ������ռ������������ж�����ֱ���ſգ��������ܺͼӦ�����κ�ˮ����������ü�Һ����β��������������˳����E��C��D��A��B��H��G��F
(2)HCl��������ˮ��ʳ��ˮ�����������������ܽ⣬�����ñ���ʳ��ˮ��ȥ�����е�HCl�������ܺ��������Ʒ�Ӧ�����κ�ˮ���������ж�����ֱ���ſգ������ü�Һ����β����
�ʴ�Ϊ����ȥCl2�е�HCl������β����
(3)��������ǿ�����ԣ����������������ɵ⣬����������Һ����ɫ�����Կ����������ǵ���KI��ֽ���������ӷ���ʽΪ2I+Cl2=I2+2Cl��
�ʴ�Ϊ������KI��ֽ������2I+Cl2=I2+2Cl��
��4���ٷ���װ�����Ƕ������̺�Ũ������ȷ�Ӧ�����Ȼ��̡�������ˮ����Ӧ����ʽΪ��MnO2+4H++2Cl-��Ũ��![]() Mn2++Cl2��+2H2O��
Mn2++Cl2��+2H2O��
�������ж�������������Һ���գ��������������Ʒ�Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪ��Cl2+2OH-=Cl-+ClO-+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
������״����Ͻ�TiNi�����㷺�����������Ǻ�����ɴ������ߣ����ٴ�ҽ��������Ҳ���й㷺��Ӧ�á��ش��������⣺
(1)д����̬Tiԭ�ӵĵ����Ų�ʽ:_________��Ni��Ԫ�����ڱ��е�λ����_________��
(2)�����Ͻ��������ȵ���������Ti(SO4)2��NiSO4�����������ӵ����幹��Ϊ______������ԭ�ӵĹ���ӻ�������_______��
(3)��ҵ�Ͻ����ʯ(��Ҫ�ɷ�TiO2)ת��ΪҺ̬TiCl4�����ý���þ�ڸ����»�ԭ�õ������ѣ�ͬʱ����MgCl2��
��MgCl2���۷е��TiCl4�ߵö࣬��ԭ����______��
��ԭ�Ӱ뾶r(Cl)_____r(Mg)�����Ӱ뾶r(O2-)______r(Mg2+)(���������������=��)��
(4)����������CO��Ӧ����һ�������Ni(CO)4(������Ϊ��ɫҺ��)��Ni(CO)4�Ĺ�������_____���壬Ni��CO֮��Ļ�ѧ����Ϊ__________���ṩ�¶Ե��ӵijɼ�ԭ����_________������Ԫ�ط��ţ�
(5)һ�������Ͻ�����������ṹ��ͼ��ʾ:
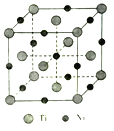
�ٸúϽ���Ti����λ��Ϊ________��
�����Ͻ���ܶ�Ϊd g/cm3�������߳�a=________pm�����ú�d�ļ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ2A(s)��3B(g) ![]() C(g)��2D(g) ��H��0����һ�������´ﵽƽ�⣬�����й�������ȷ����( ����)
C(g)��2D(g) ��H��0����һ�������´ﵽƽ�⣬�����й�������ȷ����( ����)
������A������ƽ��������Ӧ�����ƶ�
�������¶ȣ�ƽ�����淴Ӧ�����ƶ���v(��)��С
��ѹǿ����һ����ƽ�ⲻ�ƶ���v(��)��v(��)����
������B��Ũ�ȣ�v(��)��v(��)
�ݼ��������B��ת�������
A.�٢�B.��C.��D.�ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2���ǻ��춡������������ˮ����һ��Ӧ�����л��ϳɺ�ҩ������Ļ���ԭ�ϡ�

��1��2���ǻ��춡�������ķ���ʽΪ_________����ͬ��ѧ���������ں˴Ź�������ͼ���в�ͬ�����շ壬��2���ǻ��춡��������_________�����շ壻
��2���٢ڵķ�Ӧ���ͷֱ�Ϊ_________��_________��
��3����֪IΪ�������I��B�Ļ�ѧ����ʽΪ_________��
��4�����۲���F�Ľṹ��ʽΪ_________��
��5�������![]() ��
�� ��˵����ȷ����_________��˫ѡ������ĸ����
��˵����ȷ����_________��˫ѡ������ĸ����
A����������FeCl3��Һ����ɫ����ǰ�߲���
B�����߶�������NaHCO3��Һ��Ӧ�ų�CO2
C�����߶�����������������Һ������Ӧ�����������ʵ������ʱ�������������Ƶ��������
D�����߶����������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��R��Q��ԭ���������������ǰ20��Ԫ�ء�X2��ͨ��״�����ܶ���С�����壻Z��Rͬ���壬R��һ�ֹ��嵥���ڿ���������ȼ��Y��W����������֮����Z��2����W��W2��W3���ֳ������ʣ���Q�Ļ�������ɫ��Ӧ����ɫ����ش��������⣺
(1)X��W��R��Qԭ�Ӱ뾶�ɴ�С��˳����(дԪ�ط���)__________����д��Z�����ڱ��е�λ��____________________��
(2)������Ԫ����ɵ�����YW(ZX2)2��һ�����Է��ϣ���д�����ĵ���ʽ______________��
(3)�����ʵ��Ƚ�Z��RԪ�صķǽ�����ǿ��____________________��
(4)X��Y�γɵĻ������к��зǼ��Լ�����Է���������С��������________��(д��ѧʽ)
(5)R�ļ��⻯�����ǿ��ԭ�ԣ�����ͨ������ͭ��Һ������������ۺ������һ�ֵ��ʣ���д���÷�Ӧ�Ļ�ѧ����ʽ__________________________________________________��
(6)Y�������������Q������������ˮ���ﰴ���ʵ���֮��1��2��Ӧ��������Һ������Ũ���ɴ�С��˳��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̽�ն�Ա���������ᣬ��С���߽��������������˵�Ұ������ͼ��ʾ(���������ᷢ����ѧ��Ӧ������)��Сɽ��������·�ж��֣�����һ����·����ȫ�в�ͨ������Ϊ���壬��Ϊ������������������������ڣ������·�漰������Ϊ(����)

A.Na2CO3��Fe(OH)3��Zn��Fe2O3B.SO3��Cu��BaCl2��HCl
C.Zn��Fe(OH)3��KNO3��CuOD.SO3��Cu��NaCl��CuO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڵ����仯����Ļ��������У����йط�Ӧ�ķ�Ӧԭ�������о�������Ҫ���塣
��1��t��ʱ������N2��NH3��������Ӧ����Ϣ���±���ʾ��
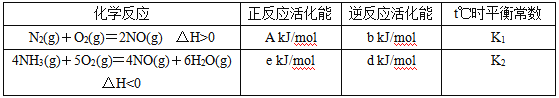
��д��t��ʱ������һ����������������������Ȼ�ѧ����ʽ��______________________��t��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ__________ (��K1��K2��ʾ)��
��2����ҵ�ϳɰ���ԭ��Ϊ��N2(g)��3H2(g)![]() 2NH3(g)��ͼ�ױ�ʾ��һ��������ܱ������з�Ӧʱ��H2�����ʵ���Ũ����ʱ��ı仯��ͼ�ұ�ʾ�������������������£���ʼͶ��H2��N2�����ʵ���֮��(��Ϊx)��ƽ��ʱNH3�����ʵ��������Ĺ�ϵ��
2NH3(g)��ͼ�ױ�ʾ��һ��������ܱ������з�Ӧʱ��H2�����ʵ���Ũ����ʱ��ı仯��ͼ�ұ�ʾ�������������������£���ʼͶ��H2��N2�����ʵ���֮��(��Ϊx)��ƽ��ʱNH3�����ʵ��������Ĺ�ϵ��
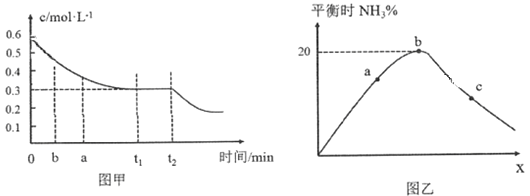
��ͼ����0��t1 min�ڣ�v(N2)��_____mol��L��1��min��1��b���v(H2)��_____a���v(H2)��(������������С��������������)��
��ͼ���У�b��ʱN2�����ʵ�������__________��
����֪ij�¶��¸÷�Ӧ��ƽ��ʱ�����ʾ�Ϊ1 mol���������Ϊ1L�������¶Ⱥ�ѹǿ���䣬�ֳ���3 mol N2��ƽ��________(���������ƶ����������ƶ����������ƶ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼij������NO������ȡNH4NO3��Һ������˵����ȷ����
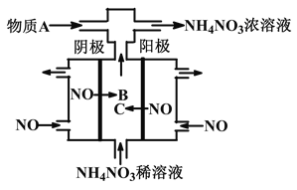
A. �����ĵ缫��ӦʽΪ��NO-3e-+2H2O=NO2-+4H+
B. ����B������C��ͬһ������
C. A���ʿ�Ϊ����
D. ����������ת�Ƶĵ�����֮��Ϊ5��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ��ͼ��ʾ�����й��ڸ��л��������˵����ȷ����( )
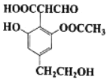
A.����������Һ��Ӧ������![]() ��Һ��Ӧ��ɫ
��Һ��Ӧ��ɫ
B.������![]() ��Ӧ��1 mol�������������
��Ӧ��1 mol�������������![]()
C.1 mol����������������Na��Ӧ��������![]()
D.1 mol������NaOH��Һ��Ӧ���������3 mol NaOH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com