
����Ŀ����֪Fe3+�������Դ���Cu2+ �� �ݴ����ʣ�ij������FeCl3��Һ��ʴ����ͭ�ľ�Ե������ӡˢ��·��
��1�������ӷ���ʽ��ʾ�仯ѧԭ�� �� ijʵ��С���ͬѧ�Ըó�����ӡˢ��·�����õķ�Һ�����˷�����ȡ50.00mL��Һ�������м���0.64g����ͭ������ͭȫ���ܽ⣻��ȡ50.00mL ��Һ�������м���������AgNO3��Һ����������43.05g����ش��������� ������ļ�����ע����Ч���֣���������λС������
��2���ó��������Һ������������������
��3���ó�ԭ��ʹ�õ�FeCl3��Һ�����ʵ���Ũ������Ӧǰ����Һ������仯���Բ��ƣ���
��4������500.00mL��Һ�м���������ϡ���ᣬ�ڱ�״��������NO����4.48L����ԭ��Һ�и����������ӵ����ʵ���Ũ��֮��Ϊ��Ҫ��ʾ����Ӧ�����ӣ�
��5����ȡ500.00mL��Һ������һ������м����ַ�Ӧ����ͭ��������������Һ��Fe2+�����ʵ�����ΧΪ ��
���𰸡�
��1��2Fe3++Cu=2Fe2++Cu2+
��2��Fe3+��Fe2+��Cu2+
��3��2mol/L
��4��c��Fe3+����c��Fe2+����c��Cu2+��=4��6��3
��5��1.2��n��Fe2+����1.5
���������⣺��1��Fe3+�����Դ���Cu2+ �� ��FeCl3��Һ��ʴ����ͭ�ľ�Ե������ӷ���ʽΪ��2Fe3++Cu=2Fe2++Cu2+ �� ���Դ��ǣ�2Fe3++Cu=2Fe2++Cu2+����2���������Һ�м������ͭ��ͭȫ���ܽ⣬����������ʣ�࣬��Һ�к����ɵ�Fe2+��Cu2+ �� ��ʣ���Fe3+ �� ��ó������ķ�Һ��������������Ϊ��Fe2+��Cu2+��Fe3+ �� ���Դ��ǣ�Fe2+��Cu2+��Fe3+����3����Һ����������AgNO3��Һ�����ɳ���43.05gΪAgCl�����������ʵ���Ϊ�� ![]() =0.3mol��������Ԫ���غ㣬ԭ��Һ��n��FeCl3��=
=0.3mol��������Ԫ���غ㣬ԭ��Һ��n��FeCl3��= ![]() n��AgCl��=��0.3mol=0.1mol�� ��ԭ��Һ��c��FeCl3��=2mol/L�����Դ��ǣ�2mol/L����4��500ml��Һ������ϡ���ᣬ���������������ӣ����ӷ���ʽ3Fe2++4H++NO3��=2H2O+3Fe3++NO������ΪNO�����ʵ���Ϊ0.2mol����������0.6mol���������ӷ���2Fe3++Cu=2Fe2++Cu2+��֪500ml��Һ��ͭ����0.3mol��50ml������������������Һ����������43.05gΪAgCl�����ʵ���Ϊ0.03mol����֪500ml��Һ�к���������Ϊ0.3mol�����ݵ���غ��֪��Һ��������Ϊ0.4mol��ͬһ��Һ�У����ʵ���֮�ȵ��������ʵ���Ũ��֮������c��Fe3+����c��Fe2+����c��Cu2+��=n��Fe3+����n��Fe2+����n��Cu2+��=0.4mol��0.6mol��0.3mol=4��6��3�����Դ��ǣ�c��Fe3+����c��Fe2+����c��Cu2+��=4��6��3����5���ɣ�4����֪500ml��Һ��n��Fe3+��=0.4mol��n��Fe2+��=0.6mol��n��Cu2+��=0.3mol��n��Cl����=3mol��
n��AgCl��=��0.3mol=0.1mol�� ��ԭ��Һ��c��FeCl3��=2mol/L�����Դ��ǣ�2mol/L����4��500ml��Һ������ϡ���ᣬ���������������ӣ����ӷ���ʽ3Fe2++4H++NO3��=2H2O+3Fe3++NO������ΪNO�����ʵ���Ϊ0.2mol����������0.6mol���������ӷ���2Fe3++Cu=2Fe2++Cu2+��֪500ml��Һ��ͭ����0.3mol��50ml������������������Һ����������43.05gΪAgCl�����ʵ���Ϊ0.03mol����֪500ml��Һ�к���������Ϊ0.3mol�����ݵ���غ��֪��Һ��������Ϊ0.4mol��ͬһ��Һ�У����ʵ���֮�ȵ��������ʵ���Ũ��֮������c��Fe3+����c��Fe2+����c��Cu2+��=n��Fe3+����n��Fe2+����n��Cu2+��=0.4mol��0.6mol��0.3mol=4��6��3�����Դ��ǣ�c��Fe3+����c��Fe2+����c��Cu2+��=4��6��3����5���ɣ�4����֪500ml��Һ��n��Fe3+��=0.4mol��n��Fe2+��=0.6mol��n��Cu2+��=0.3mol��n��Cl����=3mol��
��500.00mL����Һ�м���һ������м�����ȷ���2Fe3++Fe=3Fe2+ �� �����ӷ�Ӧ��ϣ��ٷ���Cu2++Fe=Fe2++Cu����ͭ��ʼ����ʱ����Fe3+ǡ����ȫ��Ӧ����ҺΪ�Ȼ��������Ȼ�ͭ���Һ����ʱ��Һ��Fe2+���٣����ݵ���غ��֪����ʱ��Һ�������������ʵ���Ϊn�䣨Fe2+��= ![]() =1.2mol������Һ��ͭ������ȫ��������ʱ��Һ��Fe2+��࣬��ҺΪ�Ȼ�������Һ�������������غ��֪����ʱ�����������ʵ���Ϊn�壨Fe2+��=
=1.2mol������Һ��ͭ������ȫ��������ʱ��Һ��Fe2+��࣬��ҺΪ�Ȼ�������Һ�������������غ��֪����ʱ�����������ʵ���Ϊn�壨Fe2+��= ![]() =1.5mol��������Һ��1.20��n��Fe2+����1.50�����Դ��ǣ�1.2��n��Fe2+����1.5��
=1.5mol��������Һ��1.20��n��Fe2+����1.50�����Դ��ǣ�1.2��n��Fe2+����1.5��


 ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д� ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�еĵ���ȡ������ʵ���У�����˵��������� ���� ����
A. ��Һ©��ʹ��ǰҪ�������Ƿ�©ˮ
B. ��ȡ��Ҫ������ˮ���ұ�ˮ������ʹ���ܽ�
C. ע���ˮ����ȡ������ת��Һ©������������������Һ
D. ���ñ�����ȡ������ֲ���ϲ�Һ����Ϻ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A����Է�������184.5����ṹ��ͼ1��ʾ������R������ij���������A��һ�������»�����ͼ2��ʾ�ķ�Ӧ��ϵ��D���ܷ���������Ӧ��
��1��C�к��еĹ�����Ϊ �� E��F�ķ�Ӧ����Ϊ��
��2��д��A�Ľṹ��ʽ��
��3��д��C��E�Ļ�ѧ����ʽ��
��4��H��ͬ���칹��ܶ࣬�����������࣬����������ˮ������к��������ͬ���칹������
��5��G�����ԣ�M��B����M��G���ֱ��ʾB��G����Է�������������M��G����M��B��= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.CO2��CH4������������
B.NO2��SO2��������������
C.���ͺͻ����͵���Ҫ�ɷݶ�����֬
D.ë���Ͳ�˿����Ҫ�ɷֶ��ǵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������벻����ѧ������˵������ȷ���ǣ� ��
A.��̼������Һ����ϴ������
B.��pH��ֽ���Բⶨ�����������
C.���������Զ�����ˮɱ������
D.�������������Ч��ֹȣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽΪ �����ڸ��л����˵������ȷ����(����)
�����ڸ��л����˵������ȷ����(����)
A. 1 mol���л�������2 mol NaOH������Ӧ
B. 1 mol���л�������2 mol Na��Ӧ����1 mol H2
C. 1 mol���л�������1 mol NaHCO3��Ӧ����1 mol CO2
D. 1 mol���л����������4 mol H2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ���ܱ�������X��Y��Z�����������ʼŨ�Ⱥ�ƽ��Ũ�����������˵��������ǣ� ��
���� | X | Y | Z |
��ʼŨ��/molL��1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/molL��1 | 0.05 | 0.05 | 0.1 |
A.��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50%
B.��Ӧ�ɱ�ʾΪX+3Y2Z��ƽ�ⳣ��Ϊ1600
C.������������ʱ������ѹǿ��ʹƽ�ⳣ������
D.�ı��¶ȿ��Ըı�÷�Ӧ��ƽ�ⳣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ������ȷ�����
�� | �� | �� | ���������� | ���������� | |
A | Na2CO3 | H2SO4 | Na2SO4 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO2 |
C | NaHCO3 | CH3COOH | MgCl2 | CuO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | CO |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��F�Ǽ�ͥ�г������л��A����������ȥůƿ��ˮ���е�ˮ����E��ʯ�ͻ�����չˮƽ�ı�־��F��һ�ֳ����ĸ߷��Ӳ��ϡ���������ת����ϵ�ش��������⣺
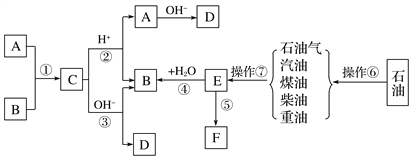
��1�������ޡ������ߵ����Ʒֱ�Ϊ________________��________________��
��2��E�Ľṹ��ʽΪ_________��
��3��B�Ĺ���������Ϊ________����B��������ȷ����________��
���ж� ������ɫ��ζ ���ܶȱ�ˮС�� �������Ը��������Һ��Ӧʹ����ɫ
���ں������ʵ��������ȡ���ӵ�ˮ����ȡ�ⵥ��
������Cu˿������������Է�����������С2���л���
A���٢ۢ� B���ڢۢ� C���ۢܢ� D���ܢݢ�
��4��д�����з�Ӧ�Ļ�ѧ����ʽ��
��д������18O��A����18O��ǵ�B��һ�������·�����Ӧ�Ļ�ѧ����ʽ(ע��������18O��λ��)��
_______________________________________________________________________��
��E��ˮ��Ӧ����B�ķ���ʽ(ע������)��
_______________________________________________________________________��
����Ϊ��ͥ�г���������,�߷��ӻ�����F�����Ǵ����˼���ķ��㣬ͬʱҲ����˻�����Ⱦ����Ӧ�ݵķ���ʽΪ��___________________________________________________________��
д���л���B�������ȵ�ͭ˿�ڿ����з�Ӧ�Ļ�ѧ����ʽ��
________________________________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com