
【题目】有机物A的相对分子质量184.5,其结构如图1所示,(﹣R﹣代表某种烷基),A在一定条件下还有如图2所示的反应关系,D不能发生银镜反应.
(1)C中含有的官能团为 , E→F的反应类型为;
(2)写出A的结构简式;
(3)写出C→E的化学方程式;
(4)H的同分异构体很多,其中属于酯类,含苯环,且水解产物中含有乙酸的同分异构体有种
(5)G显酸性,M(B),M(G)分别表示B、G的相对分子质量,试求:M(G)﹣M(B)= .
【答案】
(1)羟基、羧基;加聚反应
(2)![]()
(3)![]()
(4)4
(5)144.5
【解析】解:有机物A的相对分子质量184.5,R相对分子质量=184.5﹣12×7﹣1×5﹣35.5﹣16×2=28,所以为﹣CH2CH2﹣,则A结构简式为 ![]() ;A发生取代反应生成B,B为
;A发生取代反应生成B,B为 ![]() ,B酸化得到C,C为
,B酸化得到C,C为 ![]() ,C和A发生酯化反应生成G,G结构简式为
,C和A发生酯化反应生成G,G结构简式为 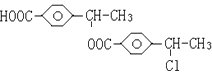 ;C被氧化生成D,D为
;C被氧化生成D,D为 ![]() ;C发生消去反应生成E,E结构简式为
;C发生消去反应生成E,E结构简式为 ![]() ,E发生加成反应生成H,H结构简式为
,E发生加成反应生成H,H结构简式为 ![]() ;E发生加成反应生成F,(1)C为
;E发生加成反应生成F,(1)C为 ![]() ,其官能团是﹣OH、﹣COOH;E生成F的反应是加聚反应,所以答案是:羟基、羧基; 加聚反应;(2)A的结构简式为
,其官能团是﹣OH、﹣COOH;E生成F的反应是加聚反应,所以答案是:羟基、羧基; 加聚反应;(2)A的结构简式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(3)C发生消去反应生成E,反应方程式为
;(3)C发生消去反应生成E,反应方程式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(4)H结构简式为
;(4)H结构简式为 ![]() ,H的同分异构体很多,其中属于酯类,含苯环,且水解产物中含有乙酸,符合条件的有乙酸苯甲酯、邻甲基乙酸苯酯、对甲基乙酸苯酯、间甲基乙酸苯酯,所以有4种, 所以答案是:4;(5)G显酸性,M(B),G结构简式为
,H的同分异构体很多,其中属于酯类,含苯环,且水解产物中含有乙酸,符合条件的有乙酸苯甲酯、邻甲基乙酸苯酯、对甲基乙酸苯酯、间甲基乙酸苯酯,所以有4种, 所以答案是:4;(5)G显酸性,M(B),G结构简式为  、B为
、B为 ![]() ,M(G)分别表示B、G的相对分子质量,G比B多9个C原子、8个H原子、1个O原子、1个Cl原子,少一个Na原子,所以M(G)﹣M(B)=12×9+1×8+1×16+1×35.5﹣1×23=144.5,
,M(G)分别表示B、G的相对分子质量,G比B多9个C原子、8个H原子、1个O原子、1个Cl原子,少一个Na原子,所以M(G)﹣M(B)=12×9+1×8+1×16+1×35.5﹣1×23=144.5,
所以答案是:144.5.


科目:高中化学 来源: 题型:
【题目】求25℃时以下溶液的pH
(1)pH=3的盐酸与pH=5的硫酸等体积混合后,pH=
(2)pH=10和pH=12的两种NaOH溶液等体积混合后,pH=
(3)pH=9的NaOH溶液稀释到原来的10倍后,pH= , 再稀释到原来的1000倍后,pH .
(4)pH=12的NaOH和pH=4的HCl等体积混合后,pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2molL﹣1 . 下列判断正确的是( )
A.A的转化率为40%
B.2 min内B的反应速率 为0.2 mol(Lmin)﹣1
C.x=2
D.若混合气体的密度不变,则表明该反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组设计如下图装置制备纯净的氯化铁。

资料:
①氯化铁遇水能发生剧烈反应生成Fe(OH)3;
②CCl4难溶于水,密度大于水,且Cl2在CCl4中的溶解度远大于水中的溶解度。
回答下列问题:
(1)试剂X的作用是__________________,试剂Y是__________________。
(2)实验过程中,A、E两处有酒精灯,应先点燃___________(填“A”或“E”)处;实验完毕后,关闭旋塞K,熄灭酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是______________,B的作用是______________________。
(3)用量简量取20mLG中溶液。倒入密封性良好的分液漏斗中,然后再注入10mL CCl4,盖好玻璃塞,振荡、静置、分液,分别取上层液、下层液滴在有色布条上,能使有色布条褪色的是__________(填“上层液”或“下层液”)。
(4)写出装置A中反应的离子方程式:_____________________________。实验结束后,测得装置E中的铁丝网质量增加mg,则理论上装置A中反应转移电子的物质的量为_________mol(用含m的式子回答)。
(5)有同学认为上述装置存在不足,用该装置制取的氯化铁中还含有其他杂质(不考虑铁),建议进行改进,请提出你的改进办法_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学对Zn.Cu、稀硫酸组成的原电池进行了探究,其中甲同学利用下图I装置进行探究,乙同学经过查阅资料后设计了图II装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。

(1)实验表明,图I中两个电极上均有气泡产生,锌电极上有气泡产生,说明反应中有一部分化学能转化为______能;铜电极上有气泡产生,说明反应中有一部分化学能转化为____能。
(2)图II中的X、Y是ZnSO4溶液及稀硫酸中的一种,实验过程中只有正极上产生气泡,则X是_________,正极上的电极反应式为__________。
(3)当图I装置的溶液质量增加63g时,生成的氢气共有______L(标准状况);当图II中锌电极质量减少65g时,电路中转移的电子数为______NA。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是( )
A. 已知工业合成氨的正反应方向放热,所以升温正反应速率降低,逆反应速率升高
B. 实验室用H2O2分解制备O2,加入MnO2后,反应速率明显加快
C. 2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3+的氧化性大于Cu2+ , 据此性质,某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路.
(1)用离子方程式表示其化学原理 . 某实验小组的同学对该厂生产印刷电路后所得的废液进行了分析:取50.00mL废液,向其中加入0.64g金属铜,金属铜全部溶解;又取50.00mL 废液,向其中加入足量的AgNO3溶液,析出沉淀43.05g.请回答以下问题 (此题的计算结果注意有效数字,即保留两位小数):
(2)该厂生产后废液中所含金属离子有;
(3)该厂原来使用的FeCl3溶液的物质的量浓度(反应前后溶液的体积变化忽略不计);
(4)若向500.00mL废液中加入足量的稀硝酸,在标准状况下生成NO气体4.48L,则原废液中各金属阳离子的物质的量浓度之比为(要表示出对应的离子)
(5)另取500.00mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为( )
A.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B.硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3 ![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D.用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH= ![]() +
+ ![]() + H2O
+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com