
【题目】一定条件下,在体积为10L的固定容器中发生的反应:N2+3H2![]() 2NH3,反应过程如下图所示,下列说法正确的是
2NH3,反应过程如下图所示,下列说法正确的是
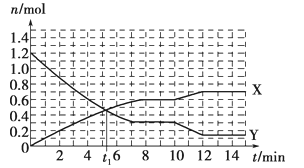
A. t1 min时正、逆反应速率相等
B. X曲线表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的平均反应速率v(H2)=0.75 mol·L-1·min-1
D. 10~12 min,N2的平均反应速率为v(N2)=0.25mol·L-1·min-1
【答案】B
【解析】试题分析: A、根据该图像,可知平衡时X的物质的量增加0.6mol,Y的物质的量减少1.2-0.3=0.9mol,0.6:0.9=2:3,说明X是氨气,Y是氢气。t1 min时X与Y的物质的量相等,但未达平衡,所以正逆反应的速率不相等,A项错误;B、X曲线表示NH3的物质的量随时间变化的关系,B项正确;C、根据A的分析可知X是氨气,正确;C、0~8 min,H2的平均反应速率v(H2)=(1.2-0.3)mol/10L/8min="0.0125" mol·L-1·min-1,C项错误;D、10~12 min,H2的平均反应速率为v(H2)=(0.3-0.15)/10L/2min="0.0075" mol·L-1·min-1,氮气的反应速率是氢气反应速率的1/3,则N2的平均反应速率为v(N2)=" 0.0075" mol·L-1·min-1/3="0.0025" mol·L-1·min-1,D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.反应产物的总焓与反应物的总焓之差,称为反应焓变
B.反应产物的总焓小于反应物的总焓,该反应为吸热反应
C.同一反应在不同温度下进行,其焓变是不同的
D.已知2NO2(g)=N2O4(g) △H1,N2O4(g)=2NO2(g) △H2,则△H1=-△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:
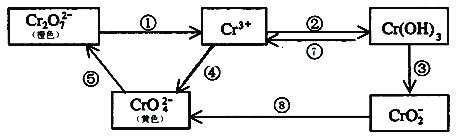
完成下列填空:
(1)①步中含Cr2O![]() 离子的废水在酸性条件下能用Fe3O4处理,反应的离子方程式为_____________;
离子的废水在酸性条件下能用Fe3O4处理,反应的离子方程式为_____________;
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:___________________________________;
(3)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
①Cr2O72-+6I-+14H+ =3I2+2Cr3++7H2O
②2S2O32-+ I2 =S4O62-+2I-,准确称取纯净的K2Cr2O7 0.294g配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。
①回收所得的Cr(OH)3在处理之前需要先进行洗涤,洗涤沉淀的方法为________________________;
②滴定时加入的指示剂通常为_________,滴定至终点的现象是_______________________________;
③Na2S2O3溶液的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1∶4)的混合气体,假定氯气在水中的溶解度可以忽略。将封闭有甲烷和氯气混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间。
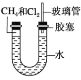
①假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式:_________________;
②若题目中甲烷与氯气的体积之比为1∶1,则得到的产物为____(填字母编号);
A.CH3Cl HCl B.CCl4 HCl C.CH3Cl CH2Cl2 D.CH3Cl CH2Cl2 CHCl3 CCl4 HCl
③经过几个小时的反应后,U形管右端的水柱变化是________ (填字母编号);
A.升高B.降低 C.不变D.无法确定
④若水中含有Na2SiO3,则在U形管左端会观察到__________________________________________;
⑤右端玻璃管的作用是_______________________。
(2)某实验小组用下列装置进行乙醇催化氧化的实验。
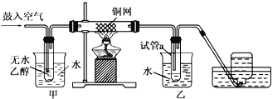
①实验过程中铜网出现红色和黑色交替出现的现象,请写出相应的化学方程式___________________、______________________ ;
②甲和乙两个装置的作用不相同,甲的作用是_____________;乙的作用是 _____________;
③反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是______________________;集气瓶收集到的气体的主要成分是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 二氧化硫既有氧化性又有还原性,在空气中易被氧化为三氧化硫
B. 标准状况下,每摩尔三氧化硫的体积约为2.24 L
C. 二氧化硫和三氧化硫都是酸性氧化物
D. 二氧化硫具有漂白性,三氧化硫具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图A、B、C是实验室常见的几种气体发生装置:
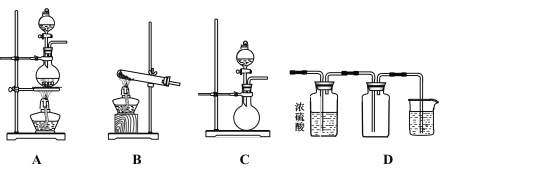
(1)实验室如果用B装置制备氨气,其化学方程式是_________________________________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是_______(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制备并收集X气体,则X可以是下列气体中的___________。
①CO2 ②NO ③Cl2 ④H2
其中在D装置中连接小烧杯的目的是________________________________。
Ⅱ.海洋是一个巨大的资源宝库,从海水中可制得食盐等多种产品并加以利用。下图所示以食盐为原料进行生产并综合利用的某些过程。

(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂
① Na2CO3 ② NaOH ③ BaCl2
沉淀剂加入顺序正确的是____________
A.③①② B.③②① C.②③① D.②①③
(2)将滤液的pH调至酸性除去的离子是____________________________________。
(3)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是____________。
(4)纯碱在生产、生活中有广泛的应用。
①由碳酸氢钠晶体制纯碱的化学方程式是____________________________________。
②纯碱可用于除灶台油污。其原因是(用离子方程式和简要文字表述)________________。
③工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是____________。(已知碳酸的酸性强于次氯酸)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)搅拌棒为何不用铜质的_____________.
(4)实验数据如下表:
①请填写下表中的空白:________。
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol·L-1NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。依据上表数据计算中和热ΔH=________(取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是______。
A.滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量硫酸溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有液态肼(N2H4)和氧气。当把0.2mol液态肼和足量氧气反应,生成氮气和水蒸气,放出128.8kJ的热量(相当于25℃、101kPa下测得的热量)。
(1)反应的热化学方程式为_____________________________________________。
(2)又已知H2O(l) = H2O(g)ΔH= +44kJ/mol。则16g液态肼与氧气生成液态水时放出的热量是____kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。
下列说法正确的是

A. 电池内的O2-由电极乙移向电极甲
B. 电池总反应为N2H4+2O2=2NO+2H2O
C. 当甲电极上有1molN2H4消耗时,乙电极上有1mol被氧化
D. 电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com