
| A. | 常温常压下,0.5molH2中含有的H原子数 | |
| B. | 22.4升HCl气体中含有的Cl原子 | |
| C. | 1L1mol/L硫酸溶液所含的H+数 | |
| D. | 0.1mol金属铝含有的电子数 |
分析 A、氢气为双原子分子;
B、HCl所处的状态不明确;
C、求出硫酸的物质的量,然后根据1mol硫酸能电离出2mol氢离子来分析;
D、铝原子含13个电子.
解答 解:A、氢气为双原子分子,故0.5mol氢气中含氢原子为1mol,个数为NA个,故A正确;
B、HCl所处的状态不明确,故其物质的量和含有的氯原子的个数无法计算,故B错误;
C、溶液中硫酸的物质的量n=CV=1mol/L×1L=1mol,而1mol硫酸能电离出2mol氢离子,故溶液中含有的氢离子的个数为2NA个,故C错误;
D、铝原子含13个电子,故0.1mol金属铝含有1.3mol电子,即1.3NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题

| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ②HNO3 | ③NaOH ④KOH | ⑤Na2SO4 ⑥K2SO4,KNO3 | ⑦SO2 ⑧SO3 | ⑨NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法不正确的是( )
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法不正确的是( )| A. | Na2O2中阴阳离子数目之比为1:2 | |
| B. | 反应①的离子方程式为:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 反应③最多能产生0.05 mol O2 | |
| D. | ①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Br-CH2Br 二溴乙烷 | B. | CH3OOCCH3甲酸乙酯 | ||
| C. | 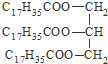 硬脂酸甘油脂 硬脂酸甘油脂 | D. | 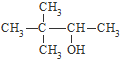 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 用氢氧化钠溶液吸收过量二氧化碳 OH-+CO2═HCO3- | |
| D. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与氯气反应制氯化铁,推出铁与碘反应制碘化铁 | |
| B. | CO2通入到漂白粉溶液中发生CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推出SO2通入到漂白粉溶液中发生SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO | |
| C. | Na2O2与CO2反应生成Na2CO3和O2,推出Na2O2与SO2反应可生成Na2SO3和O2 | |
| D. | 利用可溶性的铝盐溶液与氨水反应制Al(OH)3,推出可溶性的铁盐溶液与氨水反应制Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
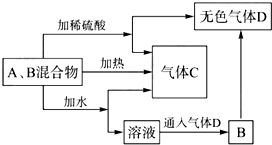 有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去).回答下列问题:
有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去).回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com