
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=1。反应前CO物质的量为1mol,平衡后CO物质的量为0.8mol。下列说法正确的是
COS(g)+H2(g) K=1。反应前CO物质的量为1mol,平衡后CO物质的量为0.8mol。下列说法正确的是
A. 羰基硫的电子式为:![]() B. 通入CO后,正反应速率逐渐增大
B. 通入CO后,正反应速率逐渐增大
C. 再加入0.1molH2S和0.1molH2,平衡不移动 D. 反应前H2S物质的量为0.25mol
【答案】D
【解析】A. 羰基硫的电子式为![]() ,故A错;B. 通入CO后,正反应速率迅速增大,故B错;
,故A错;B. 通入CO后,正反应速率迅速增大,故B错;
C. 再加入0.1molH2S和0.1molH2,设反应平衡时H2S物质的量为X,
CO(g)+H2S(g)![]() COS(g)+H2(g)
COS(g)+H2(g)
反应前浓度 1/v X/V 0 0
变化量 0.2/V 0.2/V 0.2/V 0.2/V
平衡浓度 0.8/v X/V 0.2/V 0.2 /V X=0.05mol,
再加入0.1molH2S和0.1molH2 0.8/v 0.15/V 0.2/V 0.3/V
浓度商Q= ![]() /
/![]() 代人数值 Q= 0.5 <1,平衡正向移动,故C错;D. 设反应前H2S物质的量为X,体积为V根据平衡常数K=1
代人数值 Q= 0.5 <1,平衡正向移动,故C错;D. 设反应前H2S物质的量为X,体积为V根据平衡常数K=1
CO(g)+H2S(g)![]() COS(g)+H2(g)
COS(g)+H2(g)
反应前浓度 1/v X/V 0 0
变化量 0.2/V 0.2/V 0.2/V 0.2/V
平衡浓度 0.8/v X/V- 0,2/V 0.2/V 0.2
根据平衡常数K=1.计算的X=0.25mol,故D正确。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.电离时能生成H+的化合物是酸
B.水溶液显碱性的物质是碱
C.电解质电离时产生的阴离子全部是OH-的化合物是碱
D.能与碱发生反应生成水的化合物是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氢氧化锌在碱性溶液中的变化如图所示,横坐标为溶液的pH,纵坐标为Zn2+或Zn022-的物质的量浓度的对数,下列说法正确的是
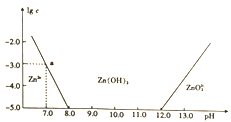
A. 依图中数据计算可得该温度下Zn(OH)2的溶度积(Ksp)=1×10-17
B. 溶液中加入足量氨水,发生反应的离子方程式为Zn2++40H-=ZnO22-+2H2O
C. 为提取工业废液中的Zn2+,可以控制溶液的pH在13左右
D. Zn2+在溶液中的存在形式与Al3+相似,碱性溶液中只以Zn(OH)2形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年5月,我国在南海成功开采“可燃冰”(甲烷水合物),标志着在技术方面取得了突破性进展。甲烷是优质的清洁能源,综合开发利用能有效缓解大气污染问题。
已知:CH4(g)+2O2(g)=CO2(g) +2H2O(g) ΔH =- 802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1
H2O(g)=H2O(l) ΔH =- 44kJ·mol-1
则1mol CH4(g)不完全燃烧生成CO和H2O(l) 的热化学方程式为:________________。
(2)甲烷转化为CO和H2的反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。
①一定条件下,CH4的平衡转化率与温度、压强的关系如下图1所示。则P1________P2(填“<”、“>”或“=”) ;A、B、C 三点处对应的平衡常数(KA、KB、KC)由大到小的顺序为___________________。
②将CH4和H2O(g)按等物质的量混合,一定条件下反应达到平衡,CH4转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为________________。
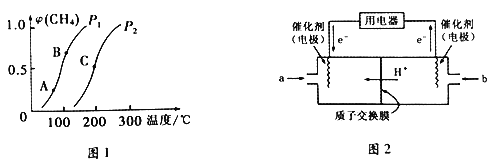
(3)甲烷燃料电池工作原理如上图2所示。a气体是______________,b气体通入电极的反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
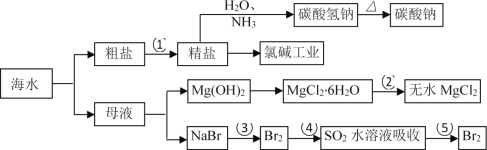
已知:MgCl2 · 6H2O 受热生成 Mg(OH)Cl 和 HCl 气体等。下列有关说法正确的是( )
A. 工业上将石灰水加入到海水中得到 Mg(OH)2 沉淀
B. 在过程②中将 MgCl2 · 6H2O 灼烧即可制得无水 MgCl2
C. 在第③、④、⑤步骤中,溴元素均被氧化
D. 制取 NaHCO3 的反应是利用其溶解度小于 NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2.L-1H2A溶液中滴另加0.2mol.L-1NaOH溶液。有关微粒的物质的量变化如图所示。根据图示判断正确的是
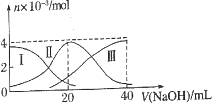
A. Ⅰ线表示A2-,Ⅱ线表示HA-
B. NaHA溶液中c(H+)>c(OH-)
C. 当V(NaOH)=21mL时:c(Na+)>c(A2-)>c(HA-)
D. 当V(NaOH)=40mL时:c(Na+)=2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO2→NO,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( ).
A.Fe3+B. MnO4-C.Cl2D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的ΔH能表示可燃物的燃烧热的是( )
A. ![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g) ΔH=-184.6 kJ·mol-1
Cl2(g)===HCl(g) ΔH=-184.6 kJ·mol-1
B. CH4(g)+2O2(g)===2H2O(g)+CO2(g) ΔH=-802 kJ·mol-1
C. CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A. 萃取 B. 加热 C. 结晶 D. 分液 E. 过滤 F. 蒸馏
(1)除去食盐水中的泥沙____。
(2)从含有少量氯化钠的硝酸钾溶液中提取硝酸钾____。
(3)分离水和汽油____。
(4)分离 CCl4 (沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物____。
Ⅱ. 实验室欲用 NaOH 固体来配制 100 mL 0.5 mol·L1 的 NaOH 溶液。
(1)配制过程中使用的仪器除托盘天平、烧杯、玻璃棒、量筒、胶头滴管外,还必须用到的玻璃仪器有____。
(2)下列主要操作步骤的正确顺序是____。(填序号)
①称取一定质量的氢氧化钠固体,放入烧杯中,用适量蒸馏水溶解;
②将容量瓶塞盖好,反复上下颠倒,摇匀;
③溶液冷却至室温,将溶液转移到容量瓶中;
④用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液都注入容量瓶中;
⑤加水至液面接近容量瓶刻度线1~2厘米处,改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切。
(3)在配制过程中,若其他操作均正确,则下列操作会引起结果偏高的是____。
A.没有洗涤烧杯和玻璃棒
B.未等 NaOH 溶液冷却至室温就转移到容量瓶中
C.溶解氢氧化钠搅拌时,液体部分溅出
D.定容时俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com