
����Ŀ����Ķ��ֻ������ڹ�ҵ������Ҫ��Ӧ�ã�
��1�������������ƣ�Na2S2O4���ֳƱ��շۣ������ʺ�ľ����ֽ��Ư������ˮ��Һ���ʲ��ȶ����м�ǿ�Ļ�ԭ�ԣ�
��Na2S2O4��SԪ�صĻ��ϼ�Ϊ ��
��Na2S2O4��¶�ڿ�����������������ˮ���������ʣ�������Ӧʱ�����������ͻ�ԭ�������ʵ���֮��Ϊl��2ʱ������Ϊ���ѧʽ����
�۽������NaOH��Һ��ϣ���ͨ��SO2���壬��õ����շۣ���ʱ���ᱻ����ΪCO2 �� �÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2��������ɻ�����Ⱦ��ij���Է�ˮ�к���Cr2O72�� �� ����ʱ���ý��������ƣ�Na2S2O3����Cr2Oת��Ϊ���Խϵ͵�Cr3+ �� �ٵ���pH��8��ʹ��Ԫ�������������������÷�ˮ��Cr3+Ũ��Ϊ0.52mg/L���ﵽ�ŷű���
��Na2S2O3�μӷ�Ӧ�����ӷ���ʽΪ ��
�ڴ�����ķ�ˮ��Cr3+�����ʵ���Ũ��Ϊ mol/L��
���𰸡�
��1��+3��NaHSO3��HCOOH+2SO2+2NaOH=Na2S2O4+CO2+H2O
��2��3S2O52��+2Cr2O72��+10H+=6SO42��+4Cr3++5H2O��1��10��5
���������⣺��1������ΪNaΪ+1�ۣ�OΪ��2�ۣ����ݻ��ϼ۴�����Ϊ0����SΪ+3�ۣ��ʴ�Ϊ��+3����Na2S2O4��¶�ڿ������ױ�������������������Ϊ��������ԭ��ΪNa2S2O4 �� ���������ͻ�ԭ�������ʵ���֮��Ϊl��2����Na2S2O4����������Ļ��ϼ�Ϊ+x�ۣ�����ݵ�ʧ�����غ㣬1��4=2��2����x��3�������x=4������ˮ�������뷴Ӧ�����Բ���ΪNaHSO3���ʴ�Ϊ��NaHSO3���۸������⣬�����NaOH��Һ��ϣ���ͨ��SO2���壬���ᱻ����ΪCO2 �� SO2���屻��ԭ��Na2S2O4 �� ��ʽΪHCOOH+2SO2+2NaOH=Na2S2O4+CO2+H2O���ʴ�Ϊ��HCOOH+2SO2+2NaOH=Na2S2O4+CO2+H2O����2���ٽ��������ƣ�Na2S2O5����Cr2O72��ת��Ϊ���Խϵ͵�Cr3+ �� ͬʱ���������Ʊ�����Ϊ�����ƣ��䷴Ӧ�����ӷ���ʽΪ��3S2O52��+2Cr2O72��+10H+=6SO42��+4Cr3++5H2O��
�ʴ�Ϊ��3S2O52��+2Cr2O72��+10H+=6SO42��+4Cr3++5H2O���ڷ����������÷�ˮ��Cr3+Ũ��Ϊ0.52mg/L��c��Cr3+��= ![]() =1��10��5mol/L��
=1��10��5mol/L��
�ʴ�Ϊ��1��10��5 ��
��1���ٸ��ݻ��ϼ۴�����Ϊ0��������Na2S2O4��¶�ڿ������ױ�������������������Ϊ��������ԭ��ΪNa2S2O4 �� ���ݵ�ʧ�����غ���㷴Ӧ�����۸������⣬�����NaOH��Һ��ϣ���ͨ��SO2���壬���ᱻ����ΪCO2 �� SO2���屻��ԭ��Na2S2O4 �� �ݴ���д����ʽ����2���ٽ��������ƣ�Na2S2O5����Cr2O72��ת��Ϊ���Խϵ͵�Cr3+ �� ͬʱ���������Ʊ�����Ϊ�����ƣ����ݵ����غ��ԭ���غ���д����ʽ���ڸ��ݷ����������÷�ˮ��Cr3+Ũ��Ϊ0.52mg/L����Cr3+�����ʵ���Ũ�ȣ�


 ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ����
A. CaO+H2O=Ca(OH)2B. SO2+2NaOH=Na2SO3+H2O
C. CaCO3+2HCl=CaCl2+CO2��+H2OD. Cl2+2KI=2KCl+I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ƿ��ɫ���廯ѧҩƷ��һƿΪNa2CO3����һƿΪNaHCO3��������������ķ�����
A. ���� B. ���߷ֱ���ͬŨ�ȵ�ϡ���ᷴӦ
C. ����ˮ������CaCl2��Һ D. ���߷ֱ����Ba (OH)2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�������������ȷ���ǣ� ��
A.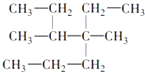 4������4��5�����һ�����
4������4��5�����һ�����
B.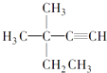 3��3��������1����Ȳ
3��3��������1����Ȳ
C.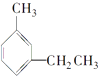 3�����һ���
3�����һ���
D.![]() 3������1��3������ϩ
3������1��3������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؼױ���ʵ����ʵ�У���˵�������Ա���������Ӱ����ǣ� ��
A.1 mol�ױ���3 mol H2�����ӳɷ�Ӧ
B.�ױ���ʹ���Ը��������Һ��ɫ���� ![]()
C.�ױ�ȼ�ղ�����Ũ�̵Ļ���
D.�ױ���Ũ���ᷴӦ�����������ױ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬϵ���У��еIJ����ܱ�KMnO4������Һ���������ɷ����ᣬ��Ӧ���£�

(1)���б���ͬϵ��ס��ң�����ʽ����C10H14���ײ��ܱ�KMnO4������Һ����Ϊ�����ᣬ���Ľṹ��ʽ��______________�����ܱ�KMnO4������Һ����Ϊ����ʽΪC8H6O4�ķ����ᣬ���ҿ��ܵĽṹ��________�֡�
(2)�л����Ҳ�DZ���ͬϵ�����ʽҲ��C10H14�����ı����ϵ�һ�����ֻ��һ�֣���д�������п��ܵĽṹ��ʽ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ������С��36��A��B��C��D��E����Ԫ�أ�ԭ��������������A��D���γ�����Һ̬��������ң�ԭ�Ӹ����ȷֱ�Ϊ2��1��1��1��B���γɻ�������������Ԫ�أ�Cԭ�ӻ�̬ʱ2pԭ�ӹ������3��δ�ɶԵĵ��ӣ�E��̬ԭ�ӵĵ�һ�ܲ�������ܲ����ĵ�������ͬ���ڶ��ܲ�������ܲ����ĵ�������ͬ��
��1��B2A2���л��ϳɹ�ҵ��һ��ԭ�ϣ� ��i����B2A2ͨ��[Cu��NH3��2]Cl��Һ����Cu2C2����ɫ������[Cu��NH3��2]Cl�д��ڵĻ�ѧ���������� �� Cu+��̬��������Ų�ʽΪ ��
��ii��B2A2��ABC��Ӧ�ɵñ�ϩ�棨H2C=CH��C��N����ABC���ӵĹ����� �� ��ϩ�������̼ԭ�ӹ���ӻ�������
��2����ҵ����EB2��A2D��Ӧ����B2A2 �� ��i��EB2�е�B22����D22+��Ϊ�ȵ����壬D22+�ĵ���ʽ�ɱ�ʾΪ��1mol D22+�к��еĦм���ĿΪ ��
��ii����ҵ��B2A2��ԭ�ϣ�EB2��A2D���Լ����B2A2���ķе�Ӹߵ���������˳��Ϊ���û�ѧʽ��ʾ����������Ϊ ��
��iii��EB2����ľ����ṹ��NaCl��������ƣ���ͼ��ʾ������EB2�����к��е���������B22���Ĵ��ڣ�ʹ������һ�����������������ı߳��ֱ�Ϊ0.387nm��0.387nm��0.637nm��EB2�����У������ӵ���λ��Ϊ �� �������������������֮��ľ���Ϊnm������3λ��Ч���֣���EB2���ܶ�g/cm3����ʽ���ɣ���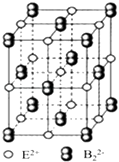
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ����1 mol��L��1������100mL����ȡ��98%��Ũ���ᣨ�ܶ�Ϊ1.84g��mL��1��______________mL(����һλС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���мס�������װ��������˵���������
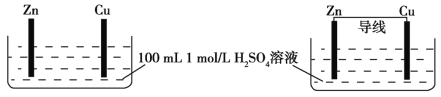
�� ��
A���ס���װ���У�Zn����������С
B���ס���װ���У�Cu�Ͼ������ݲ���
C����ѧ��Ӧ���ʣ���>��
D����װ����H+����Zn����װ����H+����Cu
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com