
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010 mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
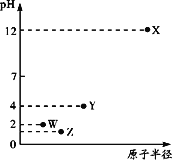
A. 简单离子半径:X>Y>Z>W
B. Y元素存在同素异形体
C. 气态氢化物的稳定性:Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH、Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。回答下列问题
Ⅰ.(1)写出晶片制绒反应的离子方程式__________,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为_______。
Ⅱ.在工业中利用镁制取硅:2Mg+SiO2![]() 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si![]() Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
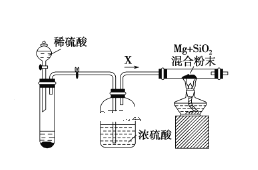
(2)由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.Na2SO3 b.锌粒 c.纯碱
(3)实验开始时,必须先通入X气体,再加热反应物,其理由是________,当反应开始后,移走酒精灯反应能继续进行,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、萃取分液 B、升华 C、降温结晶 D、分液 E、蒸馏 F、过滤
①____分离饱和食盐水与沙子的混合物;
②____从硝酸钾和氯化钠的混合液中获得硝酸钾;
③____分离水和汽油的混合物;
④____分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃);
⑤____分离出混在沙土中的碘单质。
(Ⅱ)掌握仪器名称、组装及使用方法是中学化学实验的基础。如图为实验室制取蒸馏水的实验装置。

(1)写出下列仪器的名称:a.___;b___
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器是____,将仪器补充完整后进行实验,温度计水银球的位置在___处。冷凝水由___(填f或g)口通入___(填f或g)流出。
(3)实验时a中除加入少量自来水外,还需加入少量___,其作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:______________,该反应中,Na2O2的作用为____________(填“还原剂”、“氧化剂”或“既是氧化剂又是还原剂”)。
(2)Na2O2与CO2反应可以产生氧气。某同学通过下列装置验证Na2O2能否与CO2反应。 (图中铁架台等装置已略去)。
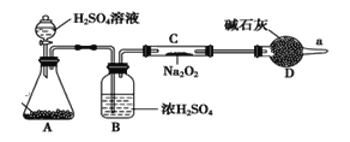
①装置A的名称是_______,A中的固体为_________,装置B中试剂的作用为______
②若Na2O2能与CO2,则装置C中的现象是____________
(3)无水氯化钙是干燥剂,在a处收集气体,检测发现该气体中几乎都是CO2气体(过氧化钠足量),则说明过氧化钠与CO2气体不反应。该同学查阅相关文献,然后撤掉装置B,其他都保留(包括试剂),连接好装置后再次进行实验,重新收集气体检测,发现得到的气体几乎都是氧气,该实验结果说明过氧化钠与CO2气体反应需要_______________。
(4)将一定量的Na2O2固体投入到含有下列离子的溶液中:SO32-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)__________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.硫酸和氢氧化钡溶液反应:Ba2++![]() =BaSO4↓
=BaSO4↓
B.AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
C.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
D.少量稀盐酸滴入Na2CO3稀溶液中:![]() +H+=
+H+=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结论正确的是( )
A.向某溶液中加入酚酞,溶液不变色,则该溶液一定显酸性
B.向某溶液中加入氯化钡溶液产生白色沉淀,再加入盐酸沉淀不消失,则该溶液中一定有 ![]()
C.向某溶液中加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有 ![]()
D.向某溶液中滴加KSCN试剂,溶液变成血红色,则该溶液中一定有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.常温常压下,18 g ![]() 所含的电子数为10NA
所含的电子数为10NA
B.56 g金属铁与氯气反应时得到的电子数为3NA
C.标准状况下,22.4 L氧气所含的氧原子数为2NA
D.常温常压下,22.4 L CO2与足量Na2O2反应转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W是由A、B两种元素组成的AB2型化合物。
(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛。则W为________________(填化学式)。
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象。往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色。
①W溶液中所含金属阳离子为________________。
②上述实验中,W与足量氯水反应的离子方程式为_________________________________________________________。
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1∶1。
①阴离子的电子式为___________________。
②1mol W与足量水充分反应,转移电子的物质的量为_____________mol。
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸。
①B在元素周期表中的位置为______________________________。
②如果常温下W为气体,W所形成的二元弱酸溶液中,含A元素的某微粒占所有含A元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为______________________;
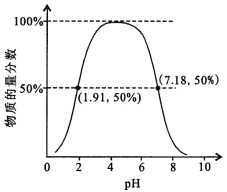
该二元弱酸的一级电离常数为Ka1,则pKa1=—lgKa1≈______________________。
③如果A元素的周期序数是B元素的两倍,W的水溶液被双氧水氧化的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图所示的实验操作,正确的是( )
A. 干燥Cl2 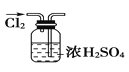
B. 配制100 mL 0.1 mol·L-1 硫酸溶液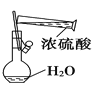
C. 分离沸点相差较大的互溶液体混合物 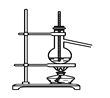
D. 分离互不相溶的两种液体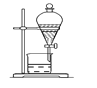
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com