
����Ŀ�������ŷ�CO2����ɡ�����ЧӦ����Ϊ�˼���úȼ�նԻ�����ɵ���Ⱦ��ú�������Ǹ�Ч���������ú̿����Ҫ;����ú�ۺ����õ�һ��;����ͼ��ʾ�� 
��1����֪C��s��+H2O��g���TCO��g��+H2��g����H1=+131.3kJmol��1 �� C��s��+2H2O��g���TCO2��g��+2H2��g����H2=+90kJmol��1 �� ��һ����̼��ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ�� ��
��2������ͼԭ���װ�ÿ�����ɹ��̢ݵ�ת������װ��b�缫�ĵ缫��Ӧʽ�� �� 
��3����ѹǿΪ0.1MPa�����£��ݻ�ΪV L���ܱ�������a mol CO��2a mol H2�ڴ��������·�Ӧ���ɼ״���CO��g��+2H2��g��CH3OH��g����CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ���� ��p1p2�����������������=������
���������������������£���������������a mol CO��2a mol H2 �� �ﵽ��ƽ��ʱ��CO��ƽ��ת���������������С�����䡱���� 
����p1�£�100��ʱ��CO��g��+2H2��g��CH3OH��g����Ӧ��ƽ�ⳣ��Ϊ���ú�a��V�Ĵ���ʽ��ʾ����
��4������ͼ��ʾCO2��H2��Ӧ����CH3OH��H2O�Ĺ�������������λΪkJmol��1���ı仯�� ���ڸ÷�Ӧ������˵���У���ȷ���������ţ���
A.��H��0����S��0
B.��H��0����S��0
C.��H��0����S��0
D.��H��0����S��0
��5��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊ1L���ܱ������У�����1mol CO2��3mol H2 �� һ�������·�����Ӧ��CO2��g��+3H2��g��CH3OH��g��+H2O��g�������CO2��g����CH3OH��g����Ũ����ʱ��仯��������ͼ��ʾ�� �ٴӷ�Ӧ��ʼ��ƽ�⣬CO2��ƽ����Ӧ����v��CO2��= ��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����������ţ���
A�������¶�
B����CH3OH��g����ʱҺ���Ƴ�
C��ѡ���Ч����
D���ٳ���1mol CO2��3mol H2 ��
���𰸡�
��1��CO��g��+H2O��g��=CO2��g��+H2��g����H=��41.3kJ?mol��1
��2��O2+4e��+2H2O�T4OH��
��3���������� ![]()
��4��C
��5��0.075mol?L��1?min��1��BD
���������⣺��1��C��s��+H2O��g��=CO��g��+H2��g����H1=+131.3kJmol��1��
C��s��+2H2O��g��=CO2��g��+2H2��g����H2=+90kJmol��1��
�ɸ�˹���ɢک��ٵã�
CO��g��+H2O��g��=CO2��g��+H2��g����H=��41.3kJmol��1
���Դ��ǣ�CO��g��+H2O��g��=CO2��g��+H2��g����H=��41.3kJmol��1����2��ȼ�ϵ����ȼ����ԭ��ظ���ʧ���ӷ���������Ӧ�������������õ����������Ի���������ˮ���������缫��Ӧ��O2+4e��+2H2O�T4OH����
���Դ��ǣ�O2+4e��+2H2O�T4OH������3�����¶���ͬʱ������ֱx��ĸ����ߣ�����ѹǿΪP2��CO��ת���ʸߣ��÷�Ӧ����ӦΪ�����С�ķ�Ӧ��ѹǿ����ƽ���������С�ķ����ƶ�����������ӦӦ�ƶ���CO��ת������������P1��P2�����Դ��ǣ����������¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���a mol CO��g����2a mol H2��g������ЧΪ��ԭƽ��Ļ���������һ��ѹǿ��ƽ��������Ӧ�ƶ���CO��ת��������
���Դ��ǣ�������ѹǿΪ0.1MPa�����£��ݻ�ΪV L���ܱ�������a mol CO��2a mol H2�ڴ��������·�Ӧ���ɼ״�����
CO��g��+ | 2H2��g���T | CH3OH��g�� | |
��ʼŨ�� |
|
| 0 |
ת��Ũ�� |
|
|
|
ƽ��Ũ�� |
|
|
|
��K= 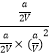 =
= ![]() ��
��
���Դ��ǣ�K= ![]() ����4�����ݷ�Ӧ��ͼ������жϣ�CO2��g��+3H2��g��CH3OH��g��+H2O��g������������ʵ������٣���Ӧ���ؼ��ٵķ�Ӧ��S��0����Ӧ������������������������жϷ�Ӧ�Ƿ��ȷ�Ӧ����H��0��
����4�����ݷ�Ӧ��ͼ������жϣ�CO2��g��+3H2��g��CH3OH��g��+H2O��g������������ʵ������٣���Ӧ���ؼ��ٵķ�Ӧ��S��0����Ӧ������������������������жϷ�Ӧ�Ƿ��ȷ�Ӧ����H��0��
���Դ��ǣ�C����5��������̼�Ƿ�Ӧ���淴Ӧ����Ũ�ȼ�С���״���������淴Ӧ����Ũ������10nim�ڴﵽƽ�⣬���ɼ״�Ũ��Ϊ0.75mol/L��������̼Ũ�ȱ仯��0.75mol/L���ٶ�����̼�ķ�Ӧ����V��CO2��= ![]() =0.075mol/Lmin��
=0.075mol/Lmin��
���Դ��ǣ�0.075 molL��1min��1�ڴ�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����ǣ�
A����Ӧ�Ƿ��ȷ�Ӧ������ƽ��������У���A����
B����CH3OH��g����ʱҺ���������С�����������ƽ��������У���B��ȷ��
C��ѡ���Ч����ֻ�ܸı����ʣ����ı仯ѧƽ�⣬��C����
D���ٳ���l molCO2��4molH2������ѹǿƽ��������У���D��ȷ��
��ѡ��BD��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����λͬѧ�����������ɫ��Һ�ֱ�������Ӽ���������ʵ�������¡�����Ϊ�������Դ������
A.K����Ca2����Cl����NO3��B.Cu2����NO3����OH����HCO3��
C.Na����OH����Cl����CO32��D.Mg2����K����SO42����Na��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������·�ӦA��g��+B��g��C��g����H��0�ﵽƽ�������ͼ���жϣ�
�ﵽ�µ�ƽ���Ӧ��ͼ�� | ƽ���ƶ����� | |
��i��ʹ�ô��� | ||
��ii������ | ||
��iii����ѹ | ||
��iv������A���� | ||
��v������C���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ý��ѧС�������ϸ�µ�ʵ��װ����ȡCl2��SO2�����о����ǵ�Ư���ԡ����ʴ�:

��1������װ��A ��ȡCl2����ѡ��������̹����Ũ����,��Ӧ�����ӷ���ʽΪ_______������װ��B��ȡSO2,��ѡ���������ƹ����Ũ����,��Ӧ�Ļ�ѧ����ʽΪ__________��
��2����Ӧ��ʼһ��ʱ���,�۲쵽C��D�����Թ��е�Ʒ����Һ_______(��д���)��
������ɫ ��������ɫ ��C��ɫ��D����ɫ ��C����ɫ��D��ɫ
ֹͣͨ����,ȡ��C��D,�ٷֱ��C��D �����Թܼ���,�����Թ��е�����ֱ�ΪC��______��D��_______��
��3���ձ�E�п�ʢװ_______(�ѧʽ)��Һ����������____________��
��4��ijͬѧ���Ƶõ�SO2��Cl2�������Ϻ�ͨ�뵽Ʒ����Һ�У��۲쵽��������________,�����ӷ���ʽ��ʾ�����������ԭ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ʺ���C��H��O��N��Ԫ�ء����й�����Ȼ���е�ѭ����˵���������
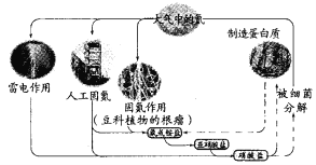
A. ��������ͺ����л�����ת��
B. ̼���⡢������Ԫ��Ҳ���ܲ����˵�ѭ��
C. ���ת��Ϊ�����Σ������˻�ԭ��Ӧ
D. Ŀǰ�˹��̵��ķ�ӦΪN2+3H2![]() 2NH3
2NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܴﵽԤ��Ŀ���ǣ� ��
A.���Ҵ���Ũ�����ȥ���������е���������
B.��ʳ�ͳ���ʯ��ˮ��֤�����к�̼����
C.ֱ��������ˮ��Һ�е���������Һ�ɲ�������
D.�÷�Һ©��������ͱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ��Ӧ��μӷ�̪����̪�ȱ�����ɫ��ijС����̽����ԭ��������ʵ��:��ȡ��Ӧ����Һ����������̺�Ѹ�ٲ�������������ʵ���������к�ɫ������ȥ�����з����������

A. ����������ˮ��Ӧ����������ΪO2
B. ����������ˮ��Ӧ��ҪMnO2������
C. ʵ��������֤��ʹ��̪��ɫ�IJ����������ƺ�����
D. ����������ˮ��Ӧ���������˾���Ư���Ե�H2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�к��еĽ���������ΪMg2����Al3���������Һ�л����ص���NaOH��Һֱ���������������������ʵ��������NaOH�����ʵ����Ĺ�ϵ��ͼ��ʾ��

(1)�ɴ�ȷ��ԭ��Һ��һ������������ij�����ӣ���������________��
(2)������ΪMgCl2��Al2(SO4)3����ԭ��Һ�������ӵ����ʵ���Ϊ______________��
(3)����ͼ���У��������ʾ�����Լ���ͨ����������ʵ������������ʾ������������������ͼ�����Ż����ֻش��������⣺

��.��ʾ��AlCl3��Һ���μ�NaOH��Һ����______��
��.��ʾ��NaAlO2��Һ���μ�ϡ�������________��
��.��ʾ��NaAlO2��Һ��ͨ��CO2����________��
��.��ͼ____________(��ܡ����ܡ�)������NaOH�ij���ʯ��ˮ��ͨ��CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������һ�����ʵ���Ũ����Һ�Ĺ���ʾ��ͼ������˵���������

A. �����Ƶ�Na2CO3,��Һ�����ʵ���Ũ��Ϊ1.0mol/L
B. ����2�ǽ��ܽ��Na2CO3,��Һת�Ƶ�����ƿ��
C. ����5�У�����ҡ�Ⱥ���Һ����ڿ̶��ߣ�Ҫ������ˮ��Һ����̶���ƽ��
D. ����4������ӣ���������ҺŨ��ƫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com