
����Ŀ��ij��ɫ��Һ�к��еĽ���������ΪMg2����Al3���������Һ�л����ص���NaOH��Һֱ���������������������ʵ��������NaOH�����ʵ����Ĺ�ϵ��ͼ��ʾ��

(1)�ɴ�ȷ��ԭ��Һ��һ������������ij�����ӣ���������________��
(2)������ΪMgCl2��Al2(SO4)3����ԭ��Һ�������ӵ����ʵ���Ϊ______________��
(3)����ͼ���У��������ʾ�����Լ���ͨ����������ʵ������������ʾ������������������ͼ�����Ż����ֻش��������⣺

��.��ʾ��AlCl3��Һ���μ�NaOH��Һ����______��
��.��ʾ��NaAlO2��Һ���μ�ϡ�������________��
��.��ʾ��NaAlO2��Һ��ͨ��CO2����________��
��.��ͼ____________(��ܡ����ܡ�)������NaOH�ij���ʯ��ˮ��ͨ��CO2��
���𰸡� ������(H��) 0.1 mol �� �� �� ����
����������1������ͼ���֪��ʼ��û�г���������˵����Һ�л����������ӣ���2������ͼ���֪�������ٽ�����������������������Һ��Ӧ���ܽ�����������������0.5mol��0.4mol��0.1mol�����ݷ���ʽAl(OH)3��NaOH��NaAlO2��2H2O��֪����������0.1mol��������ԭ���غ��֪ԭ��Һ����������0.1mol����3����.��AlCl3��Һ���μ�NaOH��Һ�����ķ�Ӧ����ΪAl3����3OH��===Al(OH)3����Al(OH)3��OH��===AlO2����2H2O�����ͼ��ٷ�������.��NaAlO2��Һ���μ�ϡ���ᷢ���ķ�Ӧ����ΪAlO2����H����2H2O===Al(OH)3����Al(OH)3��3H��===Al3����3H2O��ͼ��ݷ�������.��NaAlO2��Һ��ͨ��CO2������������������CO2������������ܽ⣬ͼ���������.��NaOH�ij���ʯ��ˮ��ͨ��CO2����������̼��Ƴ���������ͼ��۲�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��0.5 mol H2O������Ϊ____ ������______��ԭ�ӡ�
��2����������50 g�� HCl��CH4��N2���������У�ԭ����Ŀ������������_______ ������ͬ�¶Ⱥ���ͬѹǿ�����£��ܶ�����������__________ ��
��3����״����11.2L����CO��H2��ɵĻ�����������Ϊ7.2g�����������ƽ��Ħ������Ϊ_______��
��4��ʵ��������Ũ��������100 mL 1 molL-1��ϡ���ᡣ�ɹ�ѡ�õ�������:
����Ͳ;���ձ�;�۽�ͷ�ιܣ���������Ҫ�IJ���������________________ (д��������)��
��5��һ�������£�RO![]() ��Cl2�ɷ������·�Ӧ��RO3n-��Cl2��H2O==RO42����2Cl����2H+ ���Ӷ���֪��RO
��Cl2�ɷ������·�Ӧ��RO3n-��Cl2��H2O==RO42����2Cl����2H+ ���Ӷ���֪��RO![]() �У�Ԫ��R�Ļ��ϼ���_____�����б�״����8.96L Cl2������ʱ����Ӧ�й�ת�Ƶ������ʵ���Ϊ____mol��
�У�Ԫ��R�Ļ��ϼ���_____�����б�״����8.96L Cl2������ʱ����Ӧ�й�ת�Ƶ������ʵ���Ϊ____mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ŷ�CO2����ɡ�����ЧӦ����Ϊ�˼���úȼ�նԻ�����ɵ���Ⱦ��ú�������Ǹ�Ч���������ú̿����Ҫ;����ú�ۺ����õ�һ��;����ͼ��ʾ�� 
��1����֪C��s��+H2O��g���TCO��g��+H2��g����H1=+131.3kJmol��1 �� C��s��+2H2O��g���TCO2��g��+2H2��g����H2=+90kJmol��1 �� ��һ����̼��ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ�� ��
��2������ͼԭ���װ�ÿ�����ɹ��̢ݵ�ת������װ��b�缫�ĵ缫��Ӧʽ�� �� 
��3����ѹǿΪ0.1MPa�����£��ݻ�ΪV L���ܱ�������a mol CO��2a mol H2�ڴ��������·�Ӧ���ɼ״���CO��g��+2H2��g��CH3OH��g����CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ���� ��p1p2�����������������=������
���������������������£���������������a mol CO��2a mol H2 �� �ﵽ��ƽ��ʱ��CO��ƽ��ת���������������С�����䡱���� 
����p1�£�100��ʱ��CO��g��+2H2��g��CH3OH��g����Ӧ��ƽ�ⳣ��Ϊ���ú�a��V�Ĵ���ʽ��ʾ����
��4������ͼ��ʾCO2��H2��Ӧ����CH3OH��H2O�Ĺ�������������λΪkJmol��1���ı仯�� ���ڸ÷�Ӧ������˵���У���ȷ���������ţ���
A.��H��0����S��0
B.��H��0����S��0
C.��H��0����S��0
D.��H��0����S��0
��5��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊ1L���ܱ������У�����1mol CO2��3mol H2 �� һ�������·�����Ӧ��CO2��g��+3H2��g��CH3OH��g��+H2O��g�������CO2��g����CH3OH��g����Ũ����ʱ��仯��������ͼ��ʾ�� �ٴӷ�Ӧ��ʼ��ƽ�⣬CO2��ƽ����Ӧ����v��CO2��= ��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����������ţ���
A�������¶�
B����CH3OH��g����ʱҺ���Ƴ�
C��ѡ���Ч����
D���ٳ���1mol CO2��3mol H2 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ĵ���ƽ��������ͼ��ʾ�� 
��1������A���ʾ25��ʱˮ����ƽ��ʱ���ӵ�Ũ�ȣ����¶����ߵ�100��ʱ��ˮ�ĵ���ƽ��״̬�䵽B�㣨�������궼��10��6 �� �����ʱˮ�����ӻ����䵽 �� ���ˮ�����ӻ��仯��ԭ���� ��
��2����֪25��ʱ��0.1L 0.1molL��1��NaA��Һ��pH=10����NaA��Һ�������ڵ����ӵ����ʵ���Ũ���ɴ�С��˳��Ϊ
��3��25��ʱ����pH=11��NaOH��Һ��pH=4��������Һ��ϣ������û����ҺpH=9����NaOH��Һ��������Һ�������Ϊ ��
��4��100��ʱ����10�����ijǿ����Һ��1�����ijǿ����Һ��Ϻ���Һ�����ԣ�����֮ǰ����ǿ���pH��ǿ���pH֮��Ӧ����Ĺ�ϵ��
��5������25��ʱpH=2���������ߵ�100��ʱpH=����25��ʱpH=12NaOH���ߵ�100��ʱpH= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ����Ƶ�˵����ȷ����
A.�ܶȱ�ˮ��
B.�������ױ���������
C.����ˮ��Ӧ�ų�����
D.������ú���У�ʵ��ʣ��Ľ����Ʋ��ܷŻ�ԭƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������KOH�Ĵ���Һ�з�����ȥ��Ӧ���ǣ� ��
A.CH3Cl
B.��CH3��3CCH2Cl
C.![]()
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���з�Ӧ��
��SO2+H2O=H2SO3 ��C+H2O=H2+CO
��2Al+6H+=2Al3++3H2�� ��2Mg+CO2![]() 2MgO+C
2MgO+C
��2Na2O2+2H2O=4NaOH+O2�� ��Ca2C2+2H20=Ca(OH)2+C2H2��
��1��������Ӧ�в�����������ԭ��Ӧ����_________(�����Ӧ����ţ���ͬ)����Ӧ����H2O����ԭ����_______����ԭ����Ϊ���ʵ���_______��
��2����������Ӧ���漰���������У�����������ʵ���______(�ѧʽ)��
��3���õ����ű�ʾ��Ӧ���е���ת�Ƶķ������Ŀ___________________��
��4���������(K2FeO4)��Һ���Ϻ�ɫ�������м�������������ƣ���Һ�Ϻ�ɫ����ȥ�����ֺ��ɫ��������Һ��pH��������д���÷�Ӧ�����ӷ���ʽ__________________��
��5�������������������Ϊ���ʣ���д��ȥ��������������Һ����ֻ���ú�����Ԫ�ص��Լ������������ɿأ�����д����Ӧ�����ӷ���ʽ��
��Fe2O3(SiO2) �Լ�________��________________________________________��
��Na2CO3(NaAlO2) �Լ�________��________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ�Ⱥ���ˮ��������ȷ����
A.����Ϊͬһ������B.��ˮ�������ԣ�Һ��������
C.������ˮ��������ˮ��Ư����ǿD.�����£���ˮ��Һ�Ⱦ����ø�ƿ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��±������AgX��X=Cl��Br��I����3���ܽ� ƽ��������ͼ��ʾ��AgCl��AgBr��AgI��Ksp���μ�С����֪pAg=��lgc��Ag+����pX=��lgc��X����������pX��pAg������ϵ�ɱ�ʾ�� AgX���ܶȻ�����Һ�е�c��Ag+����c��X���������ϵ������˵��������ǣ� �� 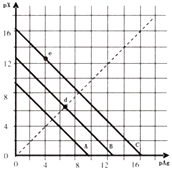
A.A����AgCl��C����Ag I
B.e���ʾ�ɹ�����KI��AgNO3��Ӧ����AgI����
C.d������ˮ�м���������AgBr�γɵı�����Һ
D.B��һ����AgBr
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com