
����Ŀ����1��0.5 mol H2O������Ϊ____ ������______��ԭ�ӡ�
��2����������50 g�� HCl��CH4��N2���������У�ԭ����Ŀ������������_______ ������ͬ�¶Ⱥ���ͬѹǿ�����£��ܶ�����������__________ ��
��3����״����11.2L����CO��H2��ɵĻ�����������Ϊ7.2g�����������ƽ��Ħ������Ϊ_______��
��4��ʵ��������Ũ��������100 mL 1 molL-1��ϡ���ᡣ�ɹ�ѡ�õ�������:
����Ͳ;���ձ�;�۽�ͷ�ιܣ���������Ҫ�IJ���������________________ (д��������)��
��5��һ�������£�RO![]() ��Cl2�ɷ������·�Ӧ��RO3n-��Cl2��H2O==RO42����2Cl����2H+ ���Ӷ���֪��RO
��Cl2�ɷ������·�Ӧ��RO3n-��Cl2��H2O==RO42����2Cl����2H+ ���Ӷ���֪��RO![]() �У�Ԫ��R�Ļ��ϼ���_____�����б�״����8.96L Cl2������ʱ����Ӧ�й�ת�Ƶ������ʵ���Ϊ____mol��
�У�Ԫ��R�Ļ��ϼ���_____�����б�״����8.96L Cl2������ʱ����Ӧ�й�ת�Ƶ������ʵ���Ϊ____mol��
���𰸡� 9g 1.5NA��9.03x1023 CH4 HCl 14.4g/moL ��������100ml����ƿ +4 0.8
����������1�����⿼�����ʵ�����������������֮���ϵ��0.5molH2O������Ϊ0.5��18g=9g��0.5molH2O�к���ԭ�����ʵ���Ϊ(0.5��2��0.5��1)mol=1.5mol��ԭ�Ӹ���Ϊ1.5NA��9.03��1023����2�����⿼�������������ʵ���������֮��Ĺ�ϵ���Լ������ӵ������۵����ã�����n=m/M��n=N/NA��50gHCl�����ʵ���Ϊ50/36.5mol��1.4mol������ԭ�����ʵ���Ϊ1.4��2mol=2.8mol��50gCH4�����ʵ���Ϊ50/16mol=3.125mol������ԭ�����ʵ���Ϊ3.125��5mol=15.625mol��50gN2�����ʵ���Ϊ50/28mol��1.8mol������ԭ�����ʵ���Ϊ1.8��2mol=3.6mol�����ԭ����Ŀ����������CH4�����ݰ����ӵ������ۣ���ͬ�¶ȡ���ͬѹǿ�£��ܶ�֮�ȵ�����Ħ������֮�ȣ�HCl��Ħ������Ϊ36.5g��mol��1��CH4Ħ������Ϊ16g��mol��1��N2��Ħ������Ϊ28g��mol��1������ܶ�������HCl����3������n=m/M���Լ�V/Vm=n������������ʵ���Ϊ11.2/22.4mol=0.5mol���������ƽ��Ħ������Ϊ7.2/0.5g��mol��1=14.4g��mol��1����4����������һ�����ʵ���Ũ����Һ����Ҫ������������100mL1mol��L��1��ϡ������Ҫ����������Ͳ���ձ�������������ͷ�ιܡ�100mL����ƿ�����ȱ�ٵ������Dz�������100mL����ƿ����5���������ӷ�Ӧ����ʽ��������ԭ��Ӧ��ʧ������Ŀ�ļ��㣬�������ӷ�Ӧ����ʽ����Ӧǰ������������غ㣬n=2��RO3n����R�Ļ��ϼ�Ϊ��4���������ӷ�Ӧ����ʽ��������Cl�Ļ��ϼ۽��ͣ����ת�Ƶ������ʵ���Ϊ8.96��2��1/22.4mol=0.8mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��һ����Ҫ�Ļ�����Ʒ��ij�����ÿ�ʴӡˢ��·������ļ��Է�Һ[���϶�[Cu(NH3)4]2+������Cu2+��NH4+��NH3��Cl-]�Ʊ�����ͭ���壬�������£�
��1��ͨ�����к͡��������ˡ��ɵü�ʽ�Ȼ�ͭ[Cu(OH)Cl]���壬�뽫���ɸù���ķ�Ӧ�����ӷ���ʽ����������[Cu(NH3)4]2+ +��
��2���Ʊ�Cu(OH)Cl����ʱ����Һ��pH��ͭԪ�غ�����Ӱ������ͼ��ʾ��
����Ҫ���Cu(OH)Cl����������Ӧ����Һ��pH������(����ĸ��ţ���
A. <5.2 B. 5.2~5.8 C. >5.8
��pH< 5.2 ʱ����pH��С����Һ��ͭԪ�غ���������ԭ���÷�Ӧ�����ӷ���ʽ�ɱ�ʾΪ��
��3�����������ữ"���̿ɵõ�����ͭ��Ʒ�������ķ�ӦΪCu(OH)Cl+ 4H2O+ H2SO4= CuSO4��5H2O+ HCl��������ͭ��Ʒ�У���ͭԪ�ص�����Ϊ �� ������Ʒ�к��и����ʵķ����ǣ�ȡ��������ͭ��Ʒ����������ˮʹ�����ܽ⣬��
��4������ͭ��Ʒ����Ҫͨ���ؽᾧ�������ᴿ����������ǣ����־����ܽ�����ˮ���γɱ�����Һ��Ȼ����������Ҵ������裬��ȴ�����˲�ϴ�ӣ��õ��ߴ��ȵ�����ͭ���塣�����Ҵ��ܹ��������ͭ�IJ��ʣ����ܽ��ԽǶȽ�������ܵ�ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����λͬѧ�����������ɫ��Һ�ֱ�������Ӽ���������ʵ�������¡�����Ϊ�������Դ������
A.K����Ca2����Cl����NO3��B.Cu2����NO3����OH����HCO3��
C.Na����OH����Cl����CO32��D.Mg2����K����SO42����Na��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ�еĵ��뷽��ʽ��д�������
A.CaCl2=Ca2����2Cl��B.Ba(OH)2=Ba2����OH2��
C.KOH=K����OH��D.H2SO4=2H����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����ij�ݻ���Ϊ2L�ܱ������г���2molN2��4molH2 �� �ڴ��������·�����Ӧ��N2��g��+3H2��g��2NH3��g����H=��92.0kJ/mol��t0ʱ�̣�����ƽ��������NH3����Ϊ2mol����t1ʱ�̿�ʼ���ı䷴Ӧ��һ����������ϵ�з�Ӧ������ʱ��仯���������ͼ��ʾ�� 
�Իش��������⣺
��1��T��ʱ��t0ʱ�̣�����ƽ���N2��ת����Ϊ�� �� �÷�Ӧ��ƽ�ⳣ��K= ��
��2��t1ʱ�̣��ı����������� ��
��3��t4ʱ�̣��ı����������� ��
��4��ƽ�ⳣ��K��t5��t6��K��t7��t8�������������=������ͬ��������ԭ���� ��
��5��T��ʱ������ƽ����������м���2molN2��2molNH3 �� ���ʱ v��v�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ܱ������з�Ӧ��2SO2+O22SO3+Q�ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a b�����иı��������������bc�����иı�������������� ������ѹǿʱ����Ӧ�ٶȱ仯�������c��d�� �� 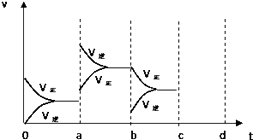
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������·�ӦA��g��+B��g��C��g����H��0�ﵽƽ�������ͼ���жϣ�
�ﵽ�µ�ƽ���Ӧ��ͼ�� | ƽ���ƶ����� | |
��i��ʹ�ô��� | ||
��ii������ | ||
��iii����ѹ | ||
��iv������A���� | ||
��v������C���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ý��ѧС�������ϸ�µ�ʵ��װ����ȡCl2��SO2�����о����ǵ�Ư���ԡ����ʴ�:

��1������װ��A ��ȡCl2����ѡ��������̹����Ũ����,��Ӧ�����ӷ���ʽΪ_______������װ��B��ȡSO2,��ѡ���������ƹ����Ũ����,��Ӧ�Ļ�ѧ����ʽΪ__________��
��2����Ӧ��ʼһ��ʱ���,�۲쵽C��D�����Թ��е�Ʒ����Һ_______(��д���)��
������ɫ ��������ɫ ��C��ɫ��D����ɫ ��C����ɫ��D��ɫ
ֹͣͨ����,ȡ��C��D,�ٷֱ��C��D �����Թܼ���,�����Թ��е�����ֱ�ΪC��______��D��_______��
��3���ձ�E�п�ʢװ_______(�ѧʽ)��Һ����������____________��
��4��ijͬѧ���Ƶõ�SO2��Cl2�������Ϻ�ͨ�뵽Ʒ����Һ�У��۲쵽��������________,�����ӷ���ʽ��ʾ�����������ԭ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�к��еĽ���������ΪMg2����Al3���������Һ�л����ص���NaOH��Һֱ���������������������ʵ��������NaOH�����ʵ����Ĺ�ϵ��ͼ��ʾ��

(1)�ɴ�ȷ��ԭ��Һ��һ������������ij�����ӣ���������________��
(2)������ΪMgCl2��Al2(SO4)3����ԭ��Һ�������ӵ����ʵ���Ϊ______________��
(3)����ͼ���У��������ʾ�����Լ���ͨ����������ʵ������������ʾ������������������ͼ�����Ż����ֻش��������⣺

��.��ʾ��AlCl3��Һ���μ�NaOH��Һ����______��
��.��ʾ��NaAlO2��Һ���μ�ϡ�������________��
��.��ʾ��NaAlO2��Һ��ͨ��CO2����________��
��.��ͼ____________(��ܡ����ܡ�)������NaOH�ij���ʯ��ˮ��ͨ��CO2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com