
【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)元素Z位于周期表中第_______周期,_______族;
(2)这些元素的氢化物中,水溶液碱性最强的是_____________(写化学式);
(3)XW2的电子式为________________________;
(4)Y的最高价氧化物的化学式为_________________。
【答案】3 ⅤA NH3 ![]() N2O5
N2O5
【解析】
根据四种短周期元素在周期表中的相对位置可知,X、Y位于第二周期,Z、W位于第三周期,其中Z元素原子核外电子总数是其最外层电子数的3倍,设核外最外层电子数为x,则有(2+8+x)=3x,解得x=5,则Z为P,X为C,Y为N,W为S,据此回答。
(1)元素Z为P,有3个电子层,最外层有5个电子,所以元素Z位于周期表中第3周期VA族。
(2)它们的气态氢化物分别为CH4—难溶于水、NH3—溶于水显碱性、PH3—溶于水显碱性、H2S —溶于水显酸性,PH3微溶于水,其水溶液的碱性弱于氨水,所以这些元素的氢化物中,水溶液碱性最强的是NH3。
(3)X为C,W为S,XW2的电子式为![]() 。
。
(4)Y为N,其最高价氧化物的化学式为N2O5。


科目:高中化学 来源: 题型:
【题目】现有下列九种物质:①盐酸溶液 ②石墨 ③蔗糖 ④CO2⑤熔融NaHSO4⑥Ba(OH)2固体 ⑦氨水 ⑧纯硫酸 ⑨NaCl固体
(1)属于电解质的有__________;属于非电解质的有________;能导电的物质有________。
(2)②和SiO2在高温下可发生如下反应:3C+SiO2![]() SiC+2CO↑ (已知SiC中Si元素为+4价),上述反应中还原产物是_______;氧化剂与还原剂物质的量之比为_______。
SiC+2CO↑ (已知SiC中Si元素为+4价),上述反应中还原产物是_______;氧化剂与还原剂物质的量之比为_______。
(3)上述九种物质中有两种物质之间可发生离子反应:H++OH-===H2O,该离子反应对应的化学方程式为________________________
(4)⑤的电离方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收利用CO2是环境科学研究的热点课题,是减轻温室效应危害的重要途径。
(1)工业上,利用天然气与二氧化碳反应制备合成气(CO和H2),化学方程式为CO2(g)+CH4(g)=2CO(g)+2H2O(g)上述反应的能量变化如图1所示,该反应是________(填“吸热反应,或“放热反应”)。

(2)工业上用CO2生产甲醇(CH3OH)燃料,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molO2和4molH2,一定条件下发-反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,用CH3OH表示的平均反应速率为______。
②若反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.v(H2)=0.01molL-1s-1 B.v(CO2)=0.15molL-1s-1
C.v(CH3OH)=0.3molL-1min-1 D.v(H2O)=0.45molL-1min-1
该反应进行由快到慢的顺序为______(填字母)。
③下列描述能说明反应达到最大限度的是_______(填字母)。
A.混合气体的密度保持不变
B.混合气体中CH3OH的体积分数约为21.4%
C.混合气体的总质量保持不变
D.H2、CH3OH的生成速率之比为3:1
(3)甲醇(CH3OH)是一种可再生能源,具有广阔的开发和应用前景。以甲醇、氧气和KOH溶液为原料,石墨为电极制造新型手机电池,甲醇在______极反应,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
分别如下,其中反应速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.

(1)该反应是_________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______(填“增大”、“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?_____(填“有”、“无”),原因是____。
(4)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1____(填“增大”、“减小”、“不变”)。
Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) ![]() PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)50~150s内的平均反应速率v(PCl3)=___________。
(2)该温度下,此反应的化学平衡常数的数值为___________。
(3)反应至250s时,该反应放出的热量为______________kJ。
(4)下列关于上述反应的说法中,正确的是__________(填字母序号)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.2molPCl3、0.5molCl2 和0.15mol PCl5,则反应向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=c(CO)c(H2O)/c(CO2)c(H2)。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应化学方程式为CO+H2O ![]() CO2+H2 B. 升高温度,逆反应速率减小
CO2+H2 B. 升高温度,逆反应速率减小
C. 恒温恒容下,增大压强,H2浓度一定减小 D. 该反应是焓变为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.  能使溴水、酸性高锰酸钾溶液褪色
能使溴水、酸性高锰酸钾溶液褪色
B. 用燃烧法鉴别乙醇、苯和四氯化碳
C. 油脂的种类很多,但它们水解后都一定有一产物相同
D. 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制银氨溶液,水浴加热,来检验蔗糖水解产物具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是

A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含极性共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
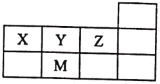
A. 原子半径:M>Z>Y>X
B. Z的气态氢化物最稳定,因其分子间存在氢键
C. 最高价氧化物对应水化物的酸性M<Z
D. 元素的非金属性:X<Y<Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com