
����Ŀ�������ֽ�������A��B��C������A����ɫ��ӦΪ��ɫ��B��C�dz������������ֽ�������A��B��C������ס��ҡ���������D��E��F��G��H֮�䷢������ת����ϵ(ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û�б��)��

�����������Ϣ�ش��������⣺
(1)д���������ʵĻ�ѧʽ����_____��B________�� G_______��
(2)д����Ӧ�ڷ�Ӧ�Ļ�ѧ����ʽ��_______����Ӧ�۵����ӷ���ʽ��________��
(3)��Ӧ��-�ܵ�4����Ӧ����������ԭ��Ӧ����_________ (��ѡ�����)
A.�٢ڢۢ� B.�٢ڢ� C.�٢ڢ� D.�٢ۢ�
(4)0.1mol�Ľ�������A��һ������ˮ��ȫ��Ӧ���ɵõ���״���µļ�����_____ L�����õ���D��Һ���Ϊ100mL������Һ�����ʵ���Ũ��Ϊ___________ ��
���𰸡�Cl2 Al FeCl3 2Al+2NaOH+2H2O=2NaAlO2+3H2 �� Fe3++3OH-=Fe(OH)3�� C 1.12 1mol/L
��������
����A��ɫ��ӦΪ��ɫ����AΪ����Na����ˮ��Ӧ����NaOH����������DΪNaOH,�����ΪH2���������������B��Ӧ�����������ʽ���BΪAl������ɫ������ΪCl2����������Ӧ���ɱ�ΪHCl��HCl����ˮ������EΪ����.��������������G��Ӧ���ɺ��ɫ����H��Fe (OH) 3��������G�к���Fe3+����ת����ϵHCl����C����F��������G,��֪����CΪFe������FΪFeCl2������GΪFeCl3��
����A��ɫ��ӦΪ��ɫ����AΪ����Na����ˮ��Ӧ����NaOH����������DΪNaOH,�����ΪH2���������������B��Ӧ�����������ʽ���BΪAl������ɫ������ΪCl2����������Ӧ���ɱ�ΪHCl��HCl����ˮ������EΪ����.��������������G��Ӧ���ɺ��ɫ����H��Fe (OH) 3��������G�к���Fe3+����ת����ϵHCl����C����F��������G,��֪����CΪFe������FΪFeCl2������GΪFeCl3��
(1)��������ķ�����֪����ΪCl2��BΪAl��GΪFeCl3���ʴ�Ϊ��Cl2��Al��FeCl3��
(2)��Ӧ�ڷ�Ӧ�Ļ�ѧ����ʽΪ2Al+2NaOH+2H2O=2NaAlO2+3H2������Ӧ�۵����ӷ���ʽΪFe3++3OH-
=Fe (OH) 3�����ʴ�Ϊ��2 Al+2NaOH+2H2O=2NaAlO2+3H2����Fe3++3OH-=Fe (OH) 3����
(3) ��Ӧ��Ϊ�������ᷴӦ������������������ԭ��Ӧ����Ӧ��Ϊ�����������Ʒ�Ӧ����������ƫ�����ƣ���������ԭ��Ӧ����Ӧ��Ϊ�����������Ȼ�����Ӧ���Ƿ�������ԭ��Ӧ����Ӧ��Ϊ�����Ȼ�����Ӧ�����Ȼ���������������ԭ��Ӧ����ѡC��
(4) 0.1mol��Na��һ������ˮ��ȫ��Ӧ�����ݵ����غ��֪���õ���״���µ��������Ϊ0.05��22.4L=1.12L�������������Ƶ����ʵ���Ϊ0.1mol������Һ���Ϊ100mL������Һ�����ʵ���Ũ��Ϊ![]() =1mol/L���ʴ�Ϊ��1.12��1mol/L��
=1mol/L���ʴ�Ϊ��1.12��1mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.������������������������Ӧ��2H++SO42-+Ba2++2OH-=BaSO4��+2H2O
B.��������Һ�������Һ��ϣ�SiO32-+2H+=H2SiO3��
C.����ˮ��Ӧ��Na+2H2O=Na��+2OH-+H2��
D.Ũ�����м���������۲����ȣ�Fe+3NO3-+6H+![]() Fe3++3NO2��+3H2O
Fe3++3NO2��+3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����о�С���������ͼ��ʾװ��(�缫���Ͼ�Ϊ��)����װ�ÿɽ���ҵ��ˮ�е��Ұ�(CH3CH2NH2)ת�����������ʡ����з����������

A. �缫NΪ��صĸ���
B. ��ع���ʱ��H+���Ҽ���ͨ������Ĥ�ƶ�������
C. N�缫�ĵ缫��Ӧ����ʽΪ2CH3CH2NH2+8H2O��30e��=4CO2��+N2��+30H+
D. ������(���躬����20%)�Ľ�����Ϊ7.5molʱ�����Դ������Ұ�9%(��������)�ķ�ˮ0.1kg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯����(������Һ)��ת����ϵ����֪�ڳ��³�ѹ�£�A�ǹ��壬B��C��D��E�Ƿǽ��������Ҷ������壬C�ʻ���ɫ��������F�ǵ���ɫ���壬������G����ɫ��ӦΪ��ɫ����������Jͨ��״���³���̬��D��E��Ӧ����һ�ִ̼�����ζ�����塣
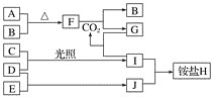
��ش��������⣺
(1)E��J�Ļ�ѧʽ�ֱ���________��________��
(2)д��F��CO2��Ӧ�Ļ�ѧ����ʽ���õ����ŷ���ʾ����ת�Ƶ������_________��
(3)����������Cͨ��ʢ�е��۵⻯����Һ���Թ��У���Һ����ɫ���÷�Ӧ�����ӷ���ʽΪ_________��
(4)�����3.36 L����B��A��ȫ��Ӧ��ת�Ƶ��ӵ���ĿΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��Ϊԭ���װ�ã��й�˵��������ǣ� ��
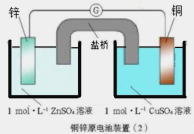
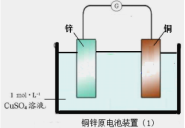
A.п��ͭ���ã�пΪ����������������Ӧ
B.������ͭ�缫����������п�缫
C.ͭ�缫�����ķ�ӦΪ��Cu��2e��= Cu2��
D.װ�ã�2����װ�ã�1�����������ʾ������з����Ļ�ѧ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǰ�����Ҫ�����ֹ��̲��ϣ��㷺Ӧ���ں��ա����ס����������ij�����ǰ��ĺϳ�·�����£����ַ�Ӧ������ȥ����

��֪��
���л���A��������˴Ź�������ͼ���£�

��
��
�ش��������⣺
(1)A��������__________________��C�к��������ŵ�������________________��
(2)��Ӧ�ڵķ�Ӧ������____________________��
(3)��Ӧ�ٵĻ�ѧ����ʽ��__________________________��
(4) F�ĽṹͲʽ��_____________________��
(5)ͬʱ��������������G��ͬ���칹�干��___________��(��������ṹ)��д������һ�ֵĽṹ��
ʽ��________________��
���ܷ���������Ӧ ���ܷ���ˮ�ⷴӦ����ˮ�����֮һ����FeC13��Һ������ɫ��Ӧ
��1 mol�������������8 mol NaOH��Ӧ
(6) ���������ϳ�·�ߣ��Լ���ױ��ͼ״�Ϊԭ�ϣ����Լ���ѡ������Ʊ� �ĺϳ�·�ߣ�_______________________��
�ĺϳ�·�ߣ�_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶������ܱ������з�����Ӧ��2M(g)��N(g) 2E(g)������ʼʱֻ����2 mol E(g)����ƽ��ʱ����������ѹǿ����ʼʱ������20%������ʼʱֻ����2 mol M��1 mol N�Ļ�����壬�ﵽƽ���M��ת����Ϊ
A.60%B.80%C.20%D.40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��֧�ź�����ͷ�����ĸֹ�����������ӵ������������������з���������ԭ����ͼ��ʾ�����и߹�����Ϊ���Ը��������������йر�������ȷ����

A. ͨ�뱣������ʹ�ֹ����港ʴ�����ӽ�����
B. ͨ������·���ӱ�ǿ�ƴӸ߹���������ֹ�
C. �߹���������������Ϊ����������Ϻʹ��ݵ���
D. ͨ��ı�������Ӧ�ø��ݻ��������仯���е���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)������ͼװ�ã�����NH3�����������MxOy��Ӧ����M��N2��H2O��ͨ����������ˮ���������ⶨM�����ԭ��������a���Լ���Ũ��ˮ��

������a������Ϊ_________������b��װ����Լ�������___________��
�ڰ�����������ȷ��װ������˳��Ϊ_________(����ĸ��װ�ÿ��ظ�ʹ��)��
(2)����������һ�ֹ�ҵ�Σ���������������Ӧ�ù㷺��������ͼ��ʾװ��(�г�װ����ʡ��)��ҩƷ��̽���������������ᷴӦ���������ɷ֡�
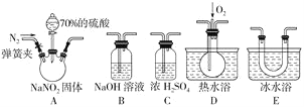
��֪����.NO+NO2+2OH-=2NO2-+H2O
��.����Һ�����¶ȣ�NO2(21��)��NO(-152��)
�ٷ�ӦǰӦ���ɼУ���ͨ��һ��ʱ�䵪����Ŀ����________________��
��Ϊ�˼���װ��A�����ɵ�����������������˳��(������������)��A��_________����װ���������������еIJ�����__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com