
【题目】某有机物A的分子式为C10H20O2,已知A~E有如图转化关系。则A的结构可能有( )
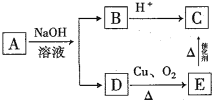
A. 16种B. 8种C. 4种D. 2种
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
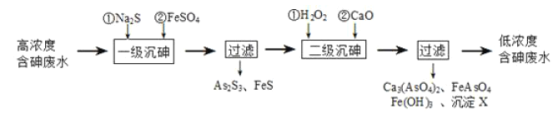
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____;砷酸的第一步电离方程式为______。
(2)“一级沉砷”中FeSO4的作用是_____;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______。
(3)沉淀X为____(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒电池是一种新型酸性硫酸盐二次电池,钒电池失效后,废电解液回收利用的一种工艺如下:

已知:a.+5价钒在溶液中存在如下平衡: ![]() 。
。
b.部分含钒物质在水中的溶解性见下表:

(1)氧化工序中,其他价态的钒全部氧化成![]() ,完成
,完成![]() 氧化的离子方程式:
氧化的离子方程式:
_________V2++_________ClO3-+ _________=_________VO2+__________C1-+ __________NaClO和NaClO3均可作氧化剂,该工序中不选择NaClO作氧化剂的理由是_________。
(2)浓缩工序中,加入NaOH的作用是_________。
(3)沉钒工序的化学方程式为_________。
(4)煅烧偏钒酸铵时,固体(取234g NH4VO3)质量的减少量随温度变化的曲线如图所示,100~200℃时产生的一种气体的电子式为________,300~350℃时发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是
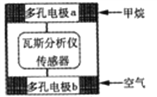
A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极b是正极,O2-由电极a流向电极b
C. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
D. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香柠檬酚具有抗氧化功能,它的结构如图,下列说法正确的是 ( )
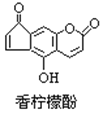
A. 它的分子式为C13H9O4
B. 它与H2发生加成反应,1mol最多可消耗7mol H2
C. 它与Br2水发生反应时,1mol最多消耗3mol Br2
D. 它与NaOH溶液反应,1mol最多消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂,制备ClO2的新工艺是电解法。
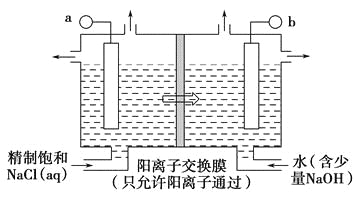
(1)如图表示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极方程式:__________________________________;图中b电极为_____________(填“阳极”或“阴极”)。
(2)电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol,阴极区pH________(填“变大”“变小”或“不变”)。
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(a mol·L-1),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g)(正反应为放热反应)该反应经过60 s时,生成0.3 mol Z,下列说法正确的是( )
Z(g)(正反应为放热反应)该反应经过60 s时,生成0.3 mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.01 mol·(L·s)-1
B.反应经过60 s时一定能达到化学平衡
C.反应放出的热量可用于提高反应速率
D.反应达到平衡时,n(X):n(Y)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
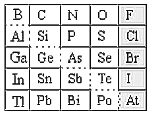
(1)元素Ga在元素周期表中的位置为:__________(写明周期和族)。
(2)Sn的最高正价为______,Cl的最高价氧化物对应水化物的化学式为_____,As的气态氢化物为_____。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是_____(填化学式)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4_____H2SeO4(填“>”、“<”或“=”)。
③氢化物的还原性:H2O_____H2S(填“>”、“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找_____(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)①Se2Cl2常用作分析试剂,其电子式为_________。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。 下列说法正确的是_____(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(6)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入_____,再加入_____,将生成气体通过_____洗气后,通入_____; | 现象:__________; 结论:非金属性C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol·L-1的溶液,溶解过程如图所示,下列说法正确的是

A. a离子为Na+
B. 溶液中含有NA个Na+
C. 水合b离子的图示不科学
D. 室温下测定该NaCl溶液的pH小于7,是由于Cl-水解导致
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com