
【题目】有一含NaCl、NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。请回答下列问题。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,A中碱石灰的作用是_______。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_______。
⑤打开活塞K1,缓缓鼓入空气数分钟,拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)实验方案的评价及数据处理
①实验步骤⑤打开活塞K1,缓缓鼓入空气数分钟的目的是__________。
②若样品质量为W g,反应后C装置增加的质量为m1 g则D装置增重的质量为______g(用含m1的代数式表达),混合物中NaHCO3的质量分数为________(用含W、m1的代数式表示)。
【答案】检查装置气密性 吸收空气中的水和二氧化碳 2NaHCO3![]() Na2CO3+H2O+CO2↑ 使反应产生的水蒸气和二氧化碳完全被C、D吸收
Na2CO3+H2O+CO2↑ 使反应产生的水蒸气和二氧化碳完全被C、D吸收 ![]()
![]() ×100%
×100%
【解析】
将混合物加热,NaHCO3受热分解产生Na2CO3、H2O、CO2,NaCl受热不发生变化,分解产生H2O(g) 在C处吸收,产生的CO2气体在D中吸收,根据C增重质量可计算出NaHCO3的质量及其分解产生的CO2的质量,从而求出NaCl的质量;为避免在实验过程中由于装置漏气或装置中空气的成分的影响,应在实验前检验装置的气密性,想法赶出装置中的空气,分解实验完毕,再通入处理过的空气,将分解产生的气体全部赶入装置C、D处,被完全吸收;E中碱石灰可防止外界空气中的H2O(g)、CO2进入装置D影响实验效果,根据以上分析进行解答即可。
(1)①按图组装好实验装置后,首先进行的操作是检查装置气密性;
③装置内有空气,空气中含有水蒸气和二氧化碳,影响水蒸气和二氧化碳质量的测定,打开活塞K1、K2,关闭活塞K3,缓缓鼓入空气数分钟,A中碱石灰的作用是吸收装置内空气中的水和二氧化碳;
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中碳酸氢钠分解生成碳酸钠、二氧化碳和水,发生反应的化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(2)①实验步骤⑤打开活塞K1,缓缓鼓入空气数分钟的目的是使NaHCO3分解产生的水蒸气和二氧化碳完全被C、D吸收;
②若样品质量为w g,反应后C装置增加的质量为m1 g,根据方程式:2NaHCO3![]() Na2CO3+H2O+CO2↑可知:每有168 g NaHCO3反应,会产生18 g H2O,44 g CO2,则反应产生m1 g水,会产生CO2的质量为m(CO2)=
Na2CO3+H2O+CO2↑可知:每有168 g NaHCO3反应,会产生18 g H2O,44 g CO2,则反应产生m1 g水,会产生CO2的质量为m(CO2)=![]() g=
g=![]() g,即D装置增重的质量为
g,即D装置增重的质量为![]() g,混合物中NaHCO3的质量为m(NaHCO3)=
g,混合物中NaHCO3的质量为m(NaHCO3)=![]() g,由于样品质量为w g,所以NaHCO3的质量分数为:
g,由于样品质量为w g,所以NaHCO3的质量分数为:![]() ×100%=
×100%=![]() ×100%。
×100%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定量的氢气在氯气中燃烧,所得混合物用100mL3.00mol·L-1的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.10mol,则反应的氢气和氯气的物质的量之比n(H2)∶n(Cl2)是( )
A.3:2B.1:3C.4:1D.1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示。请回答下列问题:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
(1)反应②是____(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=____(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在____(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v(正)___v(逆)(填“>”、“=”或“<”)。
(4)根据上述表格测得焓变,下列能量关系图合理的是_____
A. B.
B.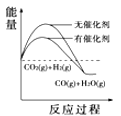 C.
C.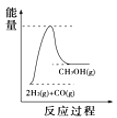 D.
D.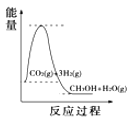
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiO2是一种化工原料,可以制备一系列物质。下列说法正确的是
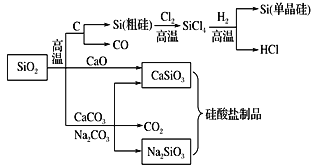
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、黏土和石英制成的,具有固定的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24 L(标准状况下),则下列情况不可能的是( )
A.加入Cu的质量为6.4 g
B.加入的浓H2SO4中含溶质0.2 mol
C.加入Cu的质量大于6.4 g
D.加入浓H2SO4中含溶质多于0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是化学中常用的物理量,请完成以下有关计算:
(1)0.2 g H2含有________个H原子。
(2)标准状况下,含有相同氧原子数的CO和CO2的体积之比为________。
(3)100 mL硫酸钠溶液中n(Na+)=0.20 mol,则其中c(SO42-)=________。
(4)在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,此氯化物的摩尔质量为________,该金属元素的相对原子质量为________。
(5)6.72 L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置正确且能达到目的的是( )
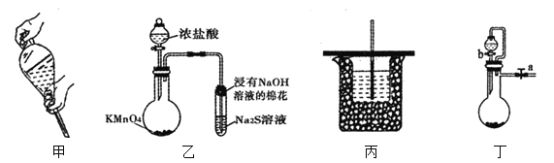
A.图甲操作将溶液转移至分液漏斗中,加入萃取剂后,塞上玻璃塞用力振摇
B.用装置乙可进行比较KMnO4、Cl2、S的氧化性强弱
C.用装置丙可进行中和热的测定
D.用装置丁,关闭a,打开b,可检验装置的气密性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制480 mL 0.5 mol·L-1的NaOH溶液,请按要求完成下列内容:
(1)完成本实验时,下列仪器中一定不需要的是________(填字母,下同)。

(2)通过计算可知,需天平称量NaOH固体的质量为______g。
(3)配制过程一般可分为以下几个步骤:①称量、②计算、③溶解、④摇匀、⑤转移、⑥洗涤、⑦定
容、⑧振荡、⑨装瓶贴签,正确的操作顺序为_____(填序号)。小明认为还缺少一个步骤,此步骤的名称是______。
(4)实验结束后,发现所配溶液浓度偏大,可能的原因是________(填代号)。
A. 所用NaOH已潮解 B. 定容时俯视观察液面
C. 未洗涤烧杯 D. 称量时砝码与NaOH的位置颠倒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图Ⅱ表示常温下,0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲线
C. 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<c
D. 图Ⅳ表示反应4CO(g)+2NO2(g ) ![]() N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com