
【题目】物质的量是化学中常用的物理量,请完成以下有关计算:
(1)0.2 g H2含有________个H原子。
(2)标准状况下,含有相同氧原子数的CO和CO2的体积之比为________。
(3)100 mL硫酸钠溶液中n(Na+)=0.20 mol,则其中c(SO42-)=________。
(4)在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,此氯化物的摩尔质量为________,该金属元素的相对原子质量为________。
(5)6.72 L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量___g。
【答案】0.2NA 2∶1 1.0 mol/L 95 g/mol 24 11.2
【解析】
(1)先根据n=![]() 计算H2的物质的量,然后根据H2分子中含有的H原子个数计算H原子数目;
计算H2的物质的量,然后根据H2分子中含有的H原子个数计算H原子数目;
(2)先计算气体的物质的量的比,然后根据V=n·Vm确定气体的体积比;
(3)根据Na2SO4电离产生的Na+、SO42-的个数关系由Na+的物质的量计算出SO42-的物质的量,再根据c=![]() 计算c(SO42-);
计算c(SO42-);
(4)根据盐的组成由Cl-的物质的量确定盐的物质的量,结合n=![]() 计算氯化物的摩尔质量,再根据摩尔质量与物质式量关系计算金属元素的相对原子质量;
计算氯化物的摩尔质量,再根据摩尔质量与物质式量关系计算金属元素的相对原子质量;
(5)先计算CO的物质的量,然后根据反应方程式计算出反应产生的Fe的物质的量和质量。
(1)0.2 gH2的物质的量是n=![]() =0.1 mol,由于H2分子中含有2个H原子,则0.1 molH2中含有0.2 molH原子,含有的H原子数目为0.2NA;
=0.1 mol,由于H2分子中含有2个H原子,则0.1 molH2中含有0.2 molH原子,含有的H原子数目为0.2NA;
(2)由于在CO、CO2分子中含有的O原子数分别是1个、2个,所以标准状况下,含有相同氧原子数的CO和CO2的物质的量的比为2:1,由于V=n·Vm,所以气体的体积比等于气体的物质的量的比,故相同条件下CO、CO2的体积比等于2:1;
(3)Na2SO4电离产生Na+、SO42-个数比为2:1,由于n(Na+)=0.20 mol,所以n(SO42-)=0.10 mol,溶液的体积是0.1 L,所以c(SO42-)=![]() =
=![]() =1.0 mol/L;
=1.0 mol/L;
(4)二价金属的氯化物中含有0.2 mol Cl-,则氯化物的物质的量为0.1 mol,由于其质量是9.5 g,所以该金属氯化物的摩尔质量为M=![]() =95 g/mol;假设金属元素用符号R表示,该氯化物化学式为RCl2,R+2×35.5=95,所以R的相对原子质量为95-71=24;
=95 g/mol;假设金属元素用符号R表示,该氯化物化学式为RCl2,R+2×35.5=95,所以R的相对原子质量为95-71=24;
(5)6.72 L CO标准状况的CO的物质的量n(CO)=6.72 L÷22.4 L/mol=0.3 mol,CO与Fe2O3反应的方程式为:3CO+Fe2O3![]() 2Fe+3CO2;由于CO的物质的量是0.3 mol,则反应产生的Fe的物质的量是0.2 mol,则生成Fe的质量m(Fe)=0.2 mol×56 g/mol=11.2 g。
2Fe+3CO2;由于CO的物质的量是0.3 mol,则反应产生的Fe的物质的量是0.2 mol,则生成Fe的质量m(Fe)=0.2 mol×56 g/mol=11.2 g。


科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g)![]() xC(g) ΔΗ=Q kJmol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
xC(g) ΔΗ=Q kJmol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
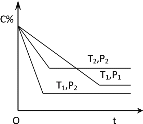
A.T1>T2,P1>P2,m+n>x,Q>0
B.T1<T2,P1<P2,m+n<x,Q>0
C.T1>T2,P1<P2,m+n<x,Q<0
D.T1<T2,P1<P2,m+n>x,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni(OH)2作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备,工艺流程如图所示。回答下列问题:

(1)“滤渣1”的成分为______(写化学式)。
(2)“除铁”中,加入NaClO的目的是_________________,为了证明加入NaClO已足量,可选择的试剂是__________ (填字母标号)。
a.KSCN溶液、氯水 b.K3[Fe(CN)6]溶液 c.NaOH溶液
(3)已知“滤渣2”的成分为黄钠铁矾,其化学式为NaFe3(SO4)2(OH)6,则“除铁”
中“Na2CO3/△”条件下生成滤渣2的离子方程式为_______________。
(4)“除镁”中,若溶液pH过小,Mg2+沉淀不完全,原因是_____________。
(5)“沉镍”的离子方程式为__________。
(6)以镍钴锰三元材料(可简写为Li1-nMO2)为一极电极材料的新型锂电池工作原理如图所示,放电时总反应为Li1-nMO2+LinC6 ![]() LiMO2+6C,则充电时b极的电极反应式为____________________。
LiMO2+6C,则充电时b极的电极反应式为____________________。
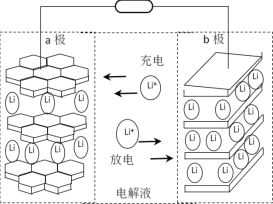
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.1molCl2与足量铁反应,转移电子数为2NA
B.3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA
C.65gZn与适量浓硫酸完全反应所得混合气体的分子数为NA
D.1L0.1 mol/L 盐酸中含H+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。请回答下列问题。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,A中碱石灰的作用是_______。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_______。
⑤打开活塞K1,缓缓鼓入空气数分钟,拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)实验方案的评价及数据处理
①实验步骤⑤打开活塞K1,缓缓鼓入空气数分钟的目的是__________。
②若样品质量为W g,反应后C装置增加的质量为m1 g则D装置增重的质量为______g(用含m1的代数式表达),混合物中NaHCO3的质量分数为________(用含W、m1的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.100 g46%的甲酸水溶液中所含的氧原子数目为 5NA
B.常温下,1L pH=7 的 lmolL-1 CH3COONH4 溶液中 CH3COO-与![]() 数目均为NA
数目均为NA
C.11 g由![]() H和
H和![]() O组成的超重水中,含有的中子数目为 5NA
O组成的超重水中,含有的中子数目为 5NA
D.高温下 ,5.6gFe 与足量的水蒸气反应,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二烯烃与溴反应制备多卤代物,反应的区域选择性在有机合成中具有重要意义。1,3–丁二烯(g) (CH2=CH—CH=CH2)和Br2(g)反应原理如下:
①CH2=CH-CH=CH2(g)+Br2(g)→![]() (g) △H1=akJ·mol-1
(g) △H1=akJ·mol-1
②CH2=CH-CH=CH2(g)+Br2(g)→ (g) △H2=bkJ·mol-1
(g) △H2=bkJ·mol-1
③![]() (g)
(g) (g) △H3
(g) △H3
回答下列问题:
(1)△H3=_____________。
(2)1,3-丁二烯和Br2反应的能量随反应过程的变化关系如图所示:

1,3-丁二烯和Br2反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为_________
(3)T℃时在2L刚性密闭容器中充入1,3-丁二烯(g)(CH2=CH-CH=CH2)和Br2(g)各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 |
1,3-丁二烯 | 100% | 72% | 0% | 0% | 0% |
1,2加成产物 | 0% | 26% | 10% | 4% | 4% |
1,4加成产物 | 0% | 2% | 90% | 96% | 96% |
在0 ~20min内,反应体系中1,4-加成产物的平均反应速率v(1,4加成产物)=_______。
(4)对于反应③,若要提高1,4-加成产物 ( )平衡体系中的物质量分数,可以采取的措施有_____
)平衡体系中的物质量分数,可以采取的措施有_____
A.适当升高温度 B.使用合适的催化剂
C.增大体系的压强 D.将1,4加成产物及时从体系分离
(5)反应 1,3-丁二烯二聚体的解聚为可逆反应:
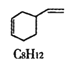 (g)
(g)![]() 2
2![]() (g) △H>0
(g) △H>0
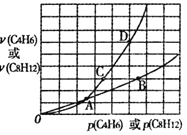
在一定条件下,C4H6和C8H12的消耗速率与各自分压有如下关系:v(C8H12)=k1·p(C8H12),v(C4H6)=k2·p2(C4H6)。相应的速率与其分压关系如图所示,一定温度下k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=_____;在图中标出点(A、B、C、D)中,能表示反应达到平衡状态的点是______ ,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究了铜片与![]() 反应的速率,实现现象记录如下表。
反应的速率,实现现象记录如下表。
实验 | 时间段 | 现象 |
|
| 铜片表面出现极少气泡 |
| 铜片表面产生较多气泡,溶液呈很浅的蓝色 | |
| 铜片表面均匀冒出大量气泡 | |
| 铜片表面产生较少气泡,溶液蓝色明显变深,液面上方呈浅棕色 |
为探究影响该反应速率的主要因素,小组进行如下实验。
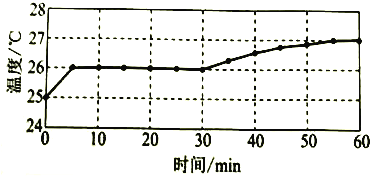
实验I:监测上述反应过程中溶液温度的变化,所得曲线如下图。
实验II:②-④试管中加入大小、形状相同的铜片和相同体积、 ![]() 。结果显示:
。结果显示:![]() 对
对![]() 和
和![]() 反应速率的影响均不明显,
反应速率的影响均不明显,![]() 能明显加快该反应的速率。
能明显加快该反应的速率。
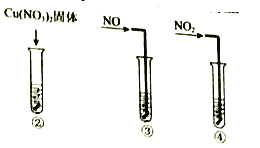
实验III:在试管中加入铜片和![]() ,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有
,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有![]() 。
。
(1)根据表格中的现象,描述该反应的速率随时间的变化情况:____________。
(2)实验![]() 的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
(3)实验II的目的是:__________
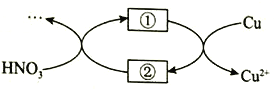
(4)小组同学查阅资料后推测:该反应由于生成某中间产物而加快了反应速率。请结合实验II、III,在下图方框内填入相应的微粒符号①____②_____,以补全催化机理。
(5)为验证(4)中猜想,还需补充一个实验:__________(请写出操作和现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学要求利用化学反应原理从源头上消除污染。以铜为原料制备硫酸铜,下列四种原理设计,其中最能体现“绿色化学”要求的是( )
A.Cu +2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B.Cu +Cl2![]() CuCl2,CuCl2+ H2SO4(浓)
CuCl2,CuCl2+ H2SO4(浓)![]() CuSO4+2HCl↑
CuSO4+2HCl↑
C.Cu + H2SO4+H2O2![]() CuSO4+2H2O
CuSO4+2H2O
D.3Cu +8HNO3=3Cu(NO3)2+2NO↑+4H2O,Cu(NO3)2+H2SO4(浓)![]() CuSO4+2HNO3↑
CuSO4+2HNO3↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com