
【题目】下列对化学平衡移动的分析中,不正确的是
① 已达平衡的反应 C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
② 已达平衡的反应 N2(g)+3H2(g)![]() 2NH3(g),当增大 N2 的浓度时,平衡向正反应方向移动,H2 的转化率一定升高
2NH3(g),当增大 N2 的浓度时,平衡向正反应方向移动,H2 的转化率一定升高
③ 有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④ 有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①②③④B.①④C.①②④D.①③④
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是
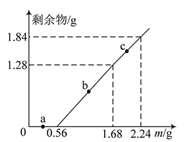
A. a点时溶液中阳离子仅为Cu2+和Fe2+
B. b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C. c点时溶液中溶质的物质的量浓度为0.5 mol·L-1
D. 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图(I)为全钒电池,电池工作原理为:2H++VO2++V2+![]() VO2++V3++H2O。装置(Ⅱ)中的电解液是硝酸、硫酸的混合水溶液,当闭合开关K时,铂电极上生成NH2OH。则下列说法正确的是( )
VO2++V3++H2O。装置(Ⅱ)中的电解液是硝酸、硫酸的混合水溶液,当闭合开关K时,铂电极上生成NH2OH。则下列说法正确的是( )
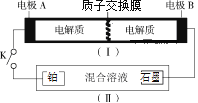
A.闭合K时,全钒电池负极区pH基本不变
B.闭合K时,铂电极的电极反应式为:NO3ˉ+6eˉ+5H2O=NH2OH +7OHˉ
C.全钒电池充电时,电极B上发生还原反应
D.全钒电池放电时,电极B上发生的反应为:VO2++2H++e-=VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种元素,它们原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D的最外层电子数是次外层电子数的3倍;E的单质是用途最广泛的半导体材料。试推断它们各是什么元素并回答下列问题:
(1)写出它们的元素符号:A________,B________,C________,D________,E________。
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为__________(用化学式表示)
(3)画出D的离子结构示意图________。
(4)用一个方程式证明B、E的非金属性的强弱_______________。
(5)写出E的最高价氧化物的一种用途:_________。
(6)由这五种元素组成的三核10电子的分子为________,四核10电子的分子是________。由这五种元素组成的四核18电子的分子为________,五核18电子的分子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列关于该有机物的说法正确的是

A. 1mol 该有机物最多与4molH2反应生成C9H16O2
B. 该有机物中所有碳原子不可能处于同一平面上
C. 该有机物能发生酯化、加成、氧化、水解等反应
D. 与该有机物具有相同官能团的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验中,通常利用如图所示的装置进行喷泉实验,来验证气体的“溶解性”,下列有关说法不正确的是

A.用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉
B.选用合适的溶液,CO2也能做喷泉实验
C.HCl、NH3和SO2均能用该装置做喷泉实验
D.用NO2气体做喷泉实验,烧瓶中将充满稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种酸性工业废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中回收氧化铁的流程如图所示:
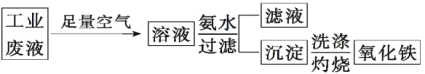
已知:常温下Ksp[Mg(OH)2]=1.2×10-11、Ksp[Fe(OH)2]=2.2×10-16、Ksp[Fe(OH)3]=3.5×10-38、Ksp[Al(OH)3]=1.0×10-33。
(1)写出在该酸性废液中通入空气时发生的反应的离子方程式:_________________,使用空气的优点是_____。
(2)常温下,在pH=5的溶液中Fe3+存在的最大浓度为_____。
(3)有人利用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用_____试剂可将其除去。
II.某研究性学习小组为探究Fe3+与Ag反应,进行如下实验:按下图连接装置并加入药品(盐桥中的物质不参与反应)。
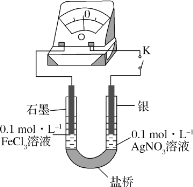
(4)K闭合时,指针向左偏转,石墨作____(填“正极”或“负极”)。
(5)当指针归零后,向左侧U形管中滴加几滴FeCl2浓溶液,发现指针向右偏转,写出此时银电极的反应式:_____。
(6)结合上述实验分析,写出Fe3+和Ag反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室检验某溶液中是否含有SO42-的操作方法是:_______________________;实验室检验某溶液中是否含有Cl-的操作方法是:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请把符合要求的化学方程式的编号填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于化合反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于分解反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
B.2Na+Cl2![]() 2NaCl
2NaCl
C.Zn+CuSO4===ZnSO4+Cu
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
E.CaO+CO2===CaCO3
F.4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②氧化剂与氧化产物的物质的量比是________。
③当有2 mol HNO3参加反应时,被氧化的物质质量为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com