
【题目】下列离子方程式正确的是( )
A.![]() 通入水中:
通入水中:![]()
B.![]() 溶液中加入过量氨水:
溶液中加入过量氨水:![]()
C.向![]() 溶液中通入足量氯气:
溶液中通入足量氯气:![]()
D.硫酸溶液和![]() 溶液反应:
溶液反应:![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有机物G(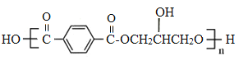 )是一种重要的有机高分子材料,实验室由有机物A制备G的一种合成路线如下:
)是一种重要的有机高分子材料,实验室由有机物A制备G的一种合成路线如下:

回答下列问题:
(1)D的名称是________B分子中含有的官能团的名称是___________________________。
(2)A→B、B→C的反应类型分别为_____________________、_________________________。
(3)下列说法正确的是_____________________(填字母编号)。
a.A分子存在顺反异构
b.可以用NaHCO3鉴别D和F
c.E分子中最多有14个原子位于同一平面上
(4)写出D+F→G的化学方程式________________________。
(5)H是F的同系物,其相对分子质量比F多28,H的核磁共振氢谱有三组峰,峰面积比为3︰1︰1,则符合该条件的H的同分异构体共有______种,写出其中H的一种结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
Ⅰ C10H18(l)==C10H12(l)+3H2(g) ΔH1 Ⅱ C10H12(l)==C10H8(l)+2H2(g) ΔH2
假设某温度下, ΔH1>ΔH2>0。在下图中绘制下列“C10H18→C10H12→C10H8”的“能量~反应过程” 示意图正确的是: ( )
A. 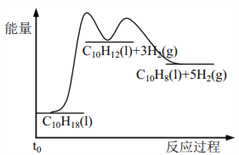 B.
B. 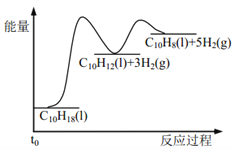
C. 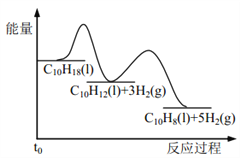 D.
D. 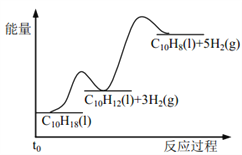
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号 | pH | 实验现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向10 mL浓度为0.01mol/L的氨水溶液中逐滴加入0.01mol/L的CH3COOH溶液,混合液的pH 与加入CH3COOH 的体积V之间的变化曲线如下图所示。下列说法正确的是
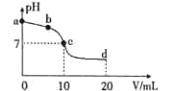
A. a点溶液的pH=12
B. b点时c(CH3COO-)>c(NH4+)
C. c点时水的电离程度最大
D. d点处微粒间存在:2c(H+)+c(CH3COO-)=2c(OH-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离提纯时常用的仪器如图所示,请回答下列问题:
A.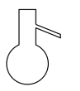 B.
B.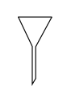 C.
C.![]() D.
D.![]() E.
E.
(1)仪器![]() 的名称分别为____、____。
的名称分别为____、____。
(2)分离以下混合物应主要选用上述哪种仪器(填字母符号)
a.除去澄清石灰水中悬浮的![]() 颗粒____;
颗粒____;
b.提取食盐水中的![]() 固体____;
固体____;
c.除去油水中的水:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G为中学化学常见的化合物,![]() 是生活中用途广泛的两种金属单质。其相互转化关系如图所示(反应条件已略去):
是生活中用途广泛的两种金属单质。其相互转化关系如图所示(反应条件已略去):
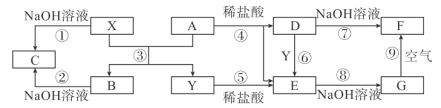
请回答下列问题
(1)![]() 的化学式分别为____、____。
的化学式分别为____、____。
(2)①~⑨中,属于非氧化还原反应的是___。
(3)反应⑨的化学方程式为_________,该反应的现象为____。
(4)反应①、④的离子方程式分别为__________、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如下图所示。步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。
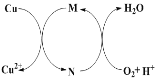
下列有关说法正确的是
A. a、b、c 之间的关系式为:a=b+c
B. 图中M、N分别为Fe2+、Fe3+
C. 步骤1充分反应后,加入少量CuO是为了除去Fe3+
D. 若制备1 mol的CuCl2,理论上消耗11.2 LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是
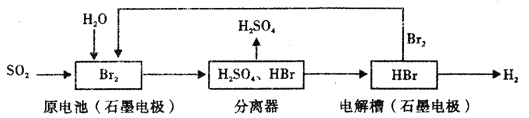
A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com