
【题目】下列关于如图所示电化学装置的分析正确的是( )
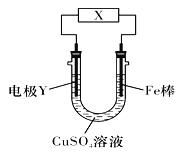
A. 若X为直流电源,Y为碳棒接负极,则Fe棒被保护
B. 若X为电流计,Y为锌棒,则SO42-移向Fe棒
C. 若X为导线,Y为铜棒,则Fe棒发生还原反应
D. 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出
【答案】D
【解析】A、若X为直流电源,Y为碳棒接负极,则Fe棒接电源的正极,作阳极,首先被氧化,因此不能起到被保护的作用,选项A错误;B、若X为电流计,Y为锌棒,则构成了原电池,Zn为负极,发生氧化反应,根据同种电荷相互排斥,异种电荷相互吸引的原则,SO42-移向正电荷较多的Zn棒,选项B错误;C、若X为导线,Y为铜棒,则构成原电池,活动性强的Fe棒为负极,发生氧化反应,选项C错误;D、若X为直流电源,Y为铜棒接正极,阳极Cu是活性电极,发生氧化反应,变为Cu2+进入溶液,在阴极铁棒上溶液中的Cu2+得到电子,变为Cu单质附着,因此可以实现Fe棒上镀铜,选项D正确。答案选D。


科目:高中化学 来源: 题型:
【题目】欲用含有少量氯化钙的氯化钠固体,配制溶质的质量分数为a%的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:

(1)称量粗盐样品m g,在托盘天平左盘上放________,右盘上放________。
(2)过滤时,漏斗下端管口应________,漏斗里液面应____________。
(3)蒸发操作时应将液体放在________中加热,等加热至________时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,反应的化学方程式为_______________________。
(5)在滤液中加入盐酸的作用是__________________,反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合F是一种重要的有机合成中间体,它的合成路线如下:
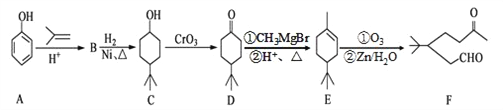
请认真分析和推理回答下列问题:
⑴化合物F中含氧官能团的名称是_______________;
⑵写出化合物C与乙酸反应生成酯的化学方程式:
____________________________________________________________________。
⑶写出化合物B的结构简式:_______________________________。
同时满足下列条件的B的同分异构体(不包括B)共有___________种:
①苯环上只有两个取代基 ②能与FeCl3溶液显紫色
⑷工业上以苯酚(![]() )和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线流程图如下:
)和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线流程图如下:
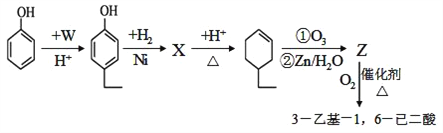
提示:3-乙基-1,6-已二酸的结构简如下图:
①写出X、Z的结构简式:
X:__________________________,Z:_________________________;
②写出苯酚与W反应的化学方程式:
_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述不正确的是

A. 图1能验证乙炔的还原性
B. 图2可用于实验室制O2
C. 图3可以看出催化剂不能改变反应的焓变
D. 图4表示KNO3的溶解度曲线,图中a点所表示的溶液时80℃时KNO3的不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质在反应3S+6KOH===2K2S+K2SO3+3H2O中的变化是
A. 被氧化B. 被还原C. 既被氧化又被还原D. 既未被氧化又未被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示。

(1)该合金的化学式为__________________;
(2)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为:______________________________________。
(3)下列关于该贮氢材料及氢气的说法中,正确的是_________( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
(4)晶体铜是面心立方堆积,在铜的一个晶胞中,把顶点上的铜原子换成Au,可得一种合金,该合金也具有储氢功能,储氢时,氢原子进入到Au和Cu原子构成的的四面体空隙中,则达到最大储氢量的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.15gNa与H2O反应,得到100mL溶液,试计算:
(1)钠失去电子的物质的量。________________
(2)生成气体的体积在标准状况下是多少毫升?____________
(3)反应后所得溶液中溶质的物质的量浓度。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的。
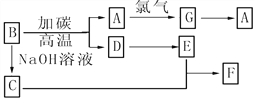
(1)试推测A________、C__________、F__________(写化学式)。
(2)试写出以下的化学方程式,是离子反应的写出离子方程式:
B→A______________;C+E→F______________
(3)在B+碳→A+D的反应中,碳的作用是________,当生成1 mol A时,转移电子的物质的量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com