
【题目】下图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的。
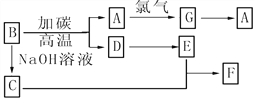
(1)试推测A________、C__________、F__________(写化学式)。
(2)试写出以下的化学方程式,是离子反应的写出离子方程式:
B→A______________;C+E→F______________
(3)在B+碳→A+D的反应中,碳的作用是________,当生成1 mol A时,转移电子的物质的量为______。
【答案】 Si Na2SiO3 H2SiO3 2C+SiO2![]() 2CO↑+Si SiO32-+CO2+H2O= H2SiO3↓+CO32- 还原剂 4mol
2CO↑+Si SiO32-+CO2+H2O= H2SiO3↓+CO32- 还原剂 4mol
【解析】A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似,则A为Si,D、E外均含有A的元素,由转化关系可知,B为SiO2,E为CO,C为Na2SiO3,D为CO,E为CO2,F为H2SiO3,G为SiCl4;
(1)由上述分析可知,A为Si,C为Na2SiO3,F为H2SiO3;
(2)B→A是SiO2与碳在高温下反应生成Si和CO,反应的方程式为:SiO2+2C![]() Si+2CO↑;C+E→F是硅酸钠溶液与过量二氧化碳反应生成硅酸与碳酸氢钠,反应离子方程式为:SiO32-+2H2O+2CO2═H2SiO3↓+2HCO3-;
Si+2CO↑;C+E→F是硅酸钠溶液与过量二氧化碳反应生成硅酸与碳酸氢钠,反应离子方程式为:SiO32-+2H2O+2CO2═H2SiO3↓+2HCO3-;
(3)B+碳→A+D的反应为:SiO2+2C![]() Si+2CO↑,反应中C元素化合价升高,碳其还原剂作用,Si元素化合价由+4降低为0价,当成1 mol Si时,转移电子的物质的量为1mol×4=4mol。
Si+2CO↑,反应中C元素化合价升高,碳其还原剂作用,Si元素化合价由+4降低为0价,当成1 mol Si时,转移电子的物质的量为1mol×4=4mol。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】下列关于如图所示电化学装置的分析正确的是( )
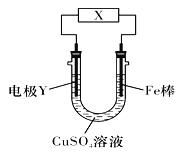
A. 若X为直流电源,Y为碳棒接负极,则Fe棒被保护
B. 若X为电流计,Y为锌棒,则SO42-移向Fe棒
C. 若X为导线,Y为铜棒,则Fe棒发生还原反应
D. 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于摩尔质量的说法正确的是
A.HNO3的摩尔质量是63g
B.物质的摩尔质量越大,物质的质量越大
C.摩尔质量就等于该物质的相对分子质量
D.醋酸的摩尔质量在数值上与NA个醋酸分子的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.分散质粒子直径在1~100nm之间
D.胶体一定条件下能聚沉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu粉放入稀H2SO4中,加热后无现象,当加入一种盐后,Cu粉质量减少,而溶液变蓝,同时有气体生成,此盐是
A. 氯化物 B. 硫酸盐 C. 硝酸盐 D. 碳酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种纯净的无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A物质18.0g,升温使其汽化,测其密度是相同条 件下H2的45倍。 | A的相对分子质量为____ |
(2)A的核磁共振氢谱如下图:
| A中含有____种氢原子且吸收峰面积比为____ |
(3)另取A18.0g与足量的NaHCO3粉末反应,生成0.2mol CO2,若与足量钠反应则生成0.2molH2。 | A中所含官能团名称为______________ |
(4)将此18.0gA在足量O2中充分燃烧,并使其产物依次 缓缓通过浓硫酸、碱石灰,发现两者依次增重10.8g和26.4g。 | A的分子式___________ |
(5)综上所述,A的结构简式为____ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢键作用常表示为“A—H…B”,其中A、B为电负性很强的一类原子,用氢键的表示方法写出HF溶液中存在的所有氢键________________________。
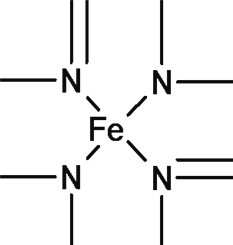
(2)已知某配合物中有如下结构,则N原子的杂化方式为___________,在结构式上用“→”标出配位键。___________
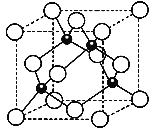
(3)Al和N组成的晶胞结构如下图一所示(“O”表示Al原子):
①则其化学式为_____,Al原子的配位数是___;
②一个N原子周围距离最近且等距的N原子有_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组的同学用下列装置进行乙醇催化氧化的实验,请回答下列问题:
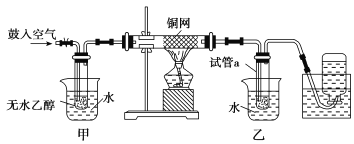
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式
__________________________________________。
熄灭酒精灯,不断地鼓入空气,反应仍能继续进行,说明乙醇的催化氧化反应是_______反应。
(2)甲和乙两个水浴作用不相同,甲的作用是_____________;乙的作用是_____________。
(3)反应进行一段时间后,集气瓶中收集到的气体的主要成分是__________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中含有_______,要除去该物质,可先在混合液中加入________(填字母序号),然后再通过________(填操作名称)即可除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化碘(ICl3)在药物合成中用途非常广泛。已知ICl3能使湿润的淀粉KI试纸变蓝。实验室可用如图装置制取ICl3(夹持装置省略)。
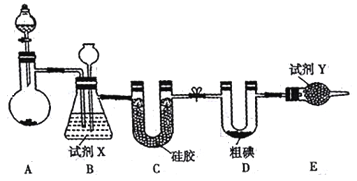
(1)制备氯气选用的药品为漂白精固体[主要成分为Ca(ClO)2]和浓盐酸,相关反应的化学方程式为_________。
(2)试剂X、Y分别是_______、_______。
(3)装置B的作用是:_______;装置E的作用是:_______。
(4)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为______。
(5)某同学欲测定ICl3 样品中ICl3的纯度,他准确称取ICl3样品10.00g于烧杯中,加入适量水和过量KI晶体,充分反应(样品中杂质不反应),反应的化学方程式为__________,将所得溶液配制成100mL待测液,取25.00mL待测液,用2.000mol·L-1的Na2S203标准液滴定(I2 +2S2O32-=2I-+S4O62-),以淀粉溶液作指示剂,达到终点时的现象为_______,重复滴定3次,测得消耗Na2S203溶液体积的平均值为20.00mL。该样品中ICl3的质量分数为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com